Иммунологическое бесплодие встречается у 10% мужчин с диагнозом бесплодие. Так называется заболевание, при котором мужской организм воспринимает собственную сперму как чужеродные клетки и вырабатывает антиспермальные антитела для их уничтожения.

Иммунологическое бесплодие делает практически невозможным естественное оплодотворение яйцеклетки.
Содержание
Причины иммунологического бесплодия
Иммунологическое бесплодие у мужчин возникает по разным причинам:
- Инфекции мочеполовой системы (ВПЧ, хламидиоз и др.).
- Хронический воспалительный процесс при простатите (воспалении предстательной железы), эпидидимите (воспалении придатка яичка).
- Травма (сильный удар по мошонке, низу живота), операция.
- Нарушения строения половых органов (варикозное расширение вен семенного канала, отсутствие семявыносящего протока).
Эти факторы приводят к тому, что естественный гемато-тестикулярный барьер между семенными протоками и кровью разрушается. В результате сперматозоиды попадают в кровоток, где вызывают иммунный ответ, в результате которого начинают вырабатываться антиспермальные антитела (ASAT). Они действуют так, как должны действовать антитела, когда сталкиваются с врагом: они покрывают поверхность сперматозоидов, разрушают мембрану сперматозоидов, обездвиживают их и склеивают вместе несколько сперматозоидов. В результате сперматозоиды теряют подвижность, способность проникать в цервикальную слизь и, даже достигая яйцеклетки, не могут растворить ее мембрану и проникнуть внутрь.
Симптомы болезни
Иммунологическое бесплодие редко сопровождается тяжелыми симптомами. У мужчины нет проблемы с эрекцией, поэтому он не может узнать о своей проблеме, пока не попытается стать отцом. Обычно иммунологическое бесплодие обнаруживается, когда пара начинает проходить обследование из-за ненаступления беременности в течение года половой жизни.
Для выявления иммунологического бесплодия проводится специальный тест MAP. Нормальная спермограмма не позволяет установить наличие антиспермальных телец.
Лечение иммунологического бесплодия у мужчин
Есть несколько способов лечения. Все должно помочь снизить выработку антиспермальных антител. Во-первых, необходимо устранить предрасполагающие факторы: вылечить урогенитальные инфекции, остановить хроническое воспаление, после травм — восстановить анатомическую целостность мошонки и так далее
После этого переходят к следующим этапам лечения. Они могут включать:
- Иммуносупрессивная терапия (подавление нежелательных иммунных реакций со стороны организма).
- Противоаллергическая терапия.
- Системная энзимотерапия (прием противовоспалительных препаратов на основе ферментов животного и растительного происхождения).
Если комплексное лечение не помогает снизить выработку АСАТ и беременность не наступает, врачи предлагают вспомогательные репродуктивные технологии (ВРТ). В зависимости от количества ACAT можно выбрать следующие методы:
- IUI (внутриматочная инсеминация). Специально подготовленная сперма вводится в матку с помощью катетера. ВМИ проводится в день овуляции.
- ЭКО (экстракорпоральное оплодотворение). Оплодотворение яйцеклетки спермой происходит в лаборатории, затем эмбрион имплантируется в матку. Экстракорпоральное оплодотворение используется, когда сперма фертильна, но не может достичь яйцеклетки.
- ИКСИ (интрацитоплазматическая микроинъекция). В яйцеклетку вводится сперма, то есть ей не нужно самостоятельно преодолевать цервикальную слизь и растворять оболочку яйца.
При подготовке к зачатию с помощью ВРТ назначают специализированные комплексы для улучшения сперматогенеза, в частности, для увеличения подвижности и жизнеспособности, а также для увеличения количества сперматозоидов правильного строения. Особенно хорошие результаты показывает Сперотон (подробнее о препарате можно узнать здесь), его эффективность при подготовке к ЭКО доказана клинически. В результате приема Сперотона увеличивается подвижность и количество сперматозоидов, улучшается их структура.
Сегодня даже мужчина с иммунологическим бесплодием может стать отцом, если обратится к специалистам по репродуктивной медицине.
ЭТО НЕ РЕКЛАМА. МАТЕРИАЛ ПОДГОТОВЛЕН С УЧАСТИЕМ СПЕЦИАЛИСТОВ.
Каковы причины иммунологического бесплодия у мужчин?
В 20% случаев мужчины бесплодны именно из-за появления аутоиммунных реакций, когда организм борется со своей собственной спермой, воспринимая ее как чужеродную. Кроме того, если от 15 до 50% сперматозоидов покрыто антиспермальными тельцами (антителами, атакующими мужские половые клетки), у мужчины все еще есть шанс зачатия при своевременном лечении, при более высоком показателе диагноз неутешительный. Наиболее частой причиной таких проблем с фертильностью является травма или инфекция. Поговорим об этом подробнее.
Травмы яичек
Мужчины, особенно в подростковом возрасте, должны заботиться о защите своих яичек во время игры в футбол, борьбы, езды на велосипеде и других занятий, которые могут привести к острой или тупой травме паха. Если сперматогенные канальцы и капилляры в яичке разрываются, сперма попадет в кровоток и подвергнется атаке антител иммунной системы. В результате значительно ухудшится качество эякулята и подвижность сперматозоидов и разовьется аутоиммунная реакция организма.
Инфекции
Не все инфекции отрицательно влияют на мужскую фертильность, но следует следить за заболеваниями мочеполовой системы. Различные вирусы (герпес, папилломы), хламидиоз, микоплазма и другие прикрепляются к сперматозоиду и вызывают выработку не только антител для борьбы с инфекцией, но и антиспермальных антител, которые атакуют мужскую сперму. Чем слабее и подвижнее сперматозоиды, тем меньше у них шансов преодолеть препятствия на пути к женской яйцеклетке.
Для диагностики аутоиммунного бесплодия может потребоваться пройти MAR, ELISA и другие исследования, и только квалифицированный андролог сможет понять причины появления антиспермальных телец.
Иммунное мужское бесплодие
 |
Бозедов В.А, доктор медицинских наук, профессор кафедры урологии и андрологии факультета фундаментальной медицины МГУ. М.В. Ломоносов, ведущий научный сотрудник ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. В.И. Кулакова», Минздрав России, научный руководитель по андрологии и репродукции поликлиники №1 ФГБУ. 3, UDP РФ |
Аутоиммунные реакции против сперматозоидов, сопровождающиеся образованием антиспермальных антител (АСАТ), снижают фертильность даже при нормозооспермии. В то же время АКАТ не всегда приводит к бесплодию. Эффект ACAT зависит от доли ACAT-положительных сперматозоидов, их количества и расположения в клетке, класса / подкласса и сродства ACAT, а также сопутствующих аномалий сперматозоидов. Проявления аутоиммунных реакций против спермы могут быть:
- нарушение сперматогенеза из-за аутоиммунного орхита;
- снижение подвижности сперматозоидов (в том числе связанных с их агглютинацией);
- отсутствие проникновения сперматозоидов в слизь шейки матки из-за появления АСАТ у женщин;
- нарушения реакции и емкости акросомы, затрудняющие оплодотворение яйцеклетки in vivo и in vitro;
- апоптоз сперматозоидов, сопровождающийся повышенной фрагментацией ДНК, что может привести к ухудшению качества эмбриона даже после экстракорпорального оплодотворения путем внутриплазматической инъекции сперматозоидов.
Формирование ACAT можно рассматривать, с одной стороны, как прямую причину снижения фертильности, а с другой — как маркер снижения качества спермы. Клинически значимыми являются прямые методы определения ACAT на поверхности прогрессивно подвижных сперматозоидов: тесты MAR (реакция смешанной агглютинации) и IBT (тесты с использованием иммунных шариков). ACAT иммуноглобулина класса A (IgA) всегда присутствуют в комбинации с IgG, а ACAT-IgG можно диагностировать даже в отсутствие IgA. Вот почему первым шагом в диагностике иммунного мужского бесплодия является определение доли IgG-позитивных подвижных сперматозоидов с помощью методов MAR или IBT. Тесты ASAT следует проводить во всех случаях бесплодного брака и раннего выкидыша. Патогенетически значимым следует считать значение MAR IgG более 12% при планировании естественного зачатия и 50% при проведении экстракорпорального оплодотворения и переноса эмбриона (ЭКО и ПЭ).
Причины появления АСАТ — непроходимость семявыносящего протока, повреждение гемато-тестикулярного барьера, перекрестные иммунные реакции с антигенами микроорганизмов, повышенная реактивность иммунной системы в ответ на экзогенные раздражители (в том числе инфекционные). Внутриклеточный оксидативный стресс (ОС) играет важную роль в патогенезе иммунного бесплодия).
Лечение иммунного бесплодия можно разделить на этиотропное, патогенетическое и симптоматическое. Этиотропное лечение основано на устранении факторов риска: непроходимость семявыносящего протока, перегревание, инфекции; во многих случаях этиотропное лечение невозможно. Патогенетическое лечение включает ферменты и антиоксиданты, клеточные продукты фетоплацентарного происхождения. Симптоматические методы — вспомогательные репродуктивные технологии (ВРТ): в виде специальной обработки (отмывки) сперматозоидов методом ACAT in vitro и внутриматочной инсеминации или ЭКО с внутриплазматической инъекцией сперматозоидов (ИКСИ) в наиболее сложных случаях. В этом направлении необходимы дальнейшие исследования для выяснения антигенов, антител, против которых они приводят к бесплодию, и для создания на этой основе антиген-специфической терапии.
Эпидемиология
По разным данным, АСАТ может быть диагностирован у 4-21% мужчин из бесплодных пар. По нашим данным, среди мужчин, обратившихся за помощью для бесплодного брака (более 3500 обследованных), АСАТ в различных количествах диагностируется в 18% случаев, в том числе у 8% мужчин, антитела покрывают более половины подвижных сперматозоидов.
Влияние на фертильность
При наличии АСАТ показатели спермограммы значительно хуже, чем у фертильных мужчин, однако корреляция между наличием АСАТ и индивидуальными показателями спермограммы слабая. Нередко более чем в четверти случаев, по нашим данным, у пациентов с иммунным бесплодием показатели спермограммы соответствуют «нормозооспермии». Но даже в этом случае реальная фертильность снижается: существует очень значимая положительная корреляция между продолжительностью принудительного бесплодия и долей прогрессивно подвижных сперматозоидов, покрытых АСАТ. Снижение фертильности при нормозооспермии на фоне АСАТ вызвано различными нарушениями функциональных возможностей сперматозоидов: акросомной реакцией, капситацией, взаимодействием рецептора с яйцеклеткой, усилением апоптоза гамет.
Многие авторы обращали внимание на то, что у ACAT-положительных пациентов эмбрионы при ЭКО и ПЭ были низкого качества. Причину этого мы смогли установить недавно. Установлено, что у пациентов со значительными уровнями АСАТ фрагментация ДНК сперматозоидов наблюдается чаще: доля сперматозоидов с фрагментацией ДНК у АСАТ-положительных пациентов была в 1,3 раза выше, чем у бесплодных мужчин без АСАТ, и в 1,6 раза выше, чем у мужчин у плодородных мужчин; есть различия в размере «ореола», который характеризует степень фрагментации ДНК. Это было установлено при сравнении групп пациентов с нормозооспермией, которые различались только наличием или отсутствием АСАТ. Эти ACAT-связанные изменения в структуре хроматина могут быть фактором, влияющим на процессы воспроизводства как во время, так и после оплодотворения яйца.
Этиология
Более десяти факторов могут вызвать развитие антиспермального иммунитета: травма яичка с орхитом или без него, вазорезекция, врожденная непроходимость семявыносящего протока, инфекция репродуктивного тракта (ИРО), травма спинного мозга, приводящая к анякуляции, пассивный гомосексуализм, психогенная анэякуляция, варикоцеле, перекрут яичка, злокачественные опухоли яичек.
Оценка абсолютного риска развития антиспермального иммунитета в наших исследованиях показала, что ASAT чаще появляется после орхита и эпидидимита (67%), тупой травмы мошонки без клинического орхита (66%), после клинически выраженного и ранее прооперированного (39-43%))… Принимая во внимание комплексное и возможное взаимодействие различных патогенетически значимых факторов, было обнаружено, что ухудшение качества спермы и риск АСАТ в группах с орхитом зависят от наличия варикоцеле. В группе мужчин, у которых орхит развился после травмы мошонки, 87% случаев имели сопутствующее варикоцеле (11% в группе с атравматическим орхитом и 35% с субклиническим орхитом). Если травма мошонки произошла у мужчин с варикоцеле, ASAT появляются в 1,2–1,4 раза, а орхит развивается в 3,4–4,1 раза чаще, чем при травме мошонки без варикоцеле.
Оценка роли IRT (Chlamydia trachomatis, Ureaplasma urealyticum, Mycoplasma hominis и др.) Показывает, что риск развития аутоиммунных реакций против сперматозоидов зависит от характеристик возбудителя: C trachomatis часто приводит к орхиту, M hominis вызывает иммунные реакции. В среднем АСАТ можно обнаружить примерно у 30% пациентов с ИРТ.
Патогенез
Патогенез иммунного мужского бесплодия можно представить следующим образом. После нарушения целостности гемато-тестикулярного барьера, образования гранулем сперматозоидов в случае непроходимости семявыносящего протока и / или в случае прикрепления микроорганизмов к поверхности сперматозоидов, фагоцитоз сперматозоидов макрофагами в репродуктивная система приводит к презентации антигенов сперматозоидов в сочетании с Т-клетками HLA I и II классов I и II классов. Происходит увеличение количества Т-клеток, специфичных к антигенам сперматозоидов, и высвобождение цитокинов, которые стимулируют дифференцировку В-клеток, специфичных к антигенам сперматозоидов, и выработку АСАТ. Наличие наследственной гиперактивности Т- и В-лимфоцитов, возможно, связанной с особенностями системы HLA, усугубляет этот процесс. Впоследствии иммунный ответ развивается по гуморальному типу с преобладанием продукции АСАТ и уменьшением количества Т-клеток. Иммунологические механизмы, которые приводят к снижению фертильности в присутствии АСАТ, — это гиперпродукция реактивных метаболитов кислорода (АФК — активные формы кислорода), лизосомальные ферменты, интерфероны (ИФН) и повышенный фагоцитоз в органах репродуктивного тракта.
На наш взгляд, ключевым фактором в развитии иммунного мужского бесплодия является ОС — следствие гиперпродукции АФК: перекиси водорода, озона и др. по нашим данным, у мужчин с иммунным бесплодием даже при отсутствии инфекционного процесса продукция АФК увеличивалась более чем в 3 раза; Между ROS и ACAT существует прямая взаимосвязь, и продукция ROS больше зависит от количества антител в сперматозоидах (согласно данным проточной цитометрии), чем от процента ACAT-положительных подвижных гамет (тест MAR). В то же время существует положительная взаимосвязь между уровнем АФК и фрагментацией ДНК сперматозоидов.
Специфические антигены сперматозоидов, стимулирующие иммунную систему, и механизмы первых реакций, приводящих к снижению фертильности, пока не известны. Можно предположить, что аутоиммунный процесс запускается не какими-то «особыми» аутоантигенами, которые безуспешно исследовались в течение нескольких десятилетий, а любым антигеном сперматозоидов, если выполняются следующие условия:
- антигены отличаются от продуктов органоспецифических генов, экспрессируемых в медуллярных эпителиальных клетках тимуса и представленных Т-клеткам во время их развития в тимусе, то есть тех, которые стали дефектными в онтогенезе на стадиях, следующих за делением сперматогоний типа А;
- сперматозоиды отсутствуют в необходимом количестве в семенной плазме в растворенном виде, что необходимо для поддержания толерантности;
- структура макромолекул трансформируется (например, под действием АФК) и приобретает антигенные свойства.
Связь, которую мы обнаружили между ACAT, OS и фрагментацией ДНК (данные опубликованы в международных журналах Andrology и Journal of Reproductive Immunology), снова поднимает вопрос о роли АРТ в лечении пациентов с мужским иммунным бесплодием, постулированный в метаанализе. А. Зини и др. (2011) положение о том, что ACAT не снижает долю беременностей после ЭКО и ИКСИ, не означает, что это не влияет на исходы беременности и здоровье детей.
Диагностика
Аналитические системы, используемые на рынке, напрямую определяют наличие антител на поверхности сперматозоидов или содержание ACAT в растворе (сперма, кровь, цервикальная слизь или фолликулярная жидкость). Методы диагностики ACAT включают тесты с полиакриламидными шариками, покрытыми ACAT (IBD — иммунные тесты), тест смешанной агглютинации — тест MAR, тест иммуноферментного анализа (ELISA), тест на агглютинацию в лотке, тест на иммобилизацию сперматозоидов, цитометрию потока (PCM) и анализы радиоактивно меченого агглютинина. Однако ни один из методов не отвечает всем требованиям врачей: для определения наличия АСАТ, их локализации, изотипа, чтобы они были высокочувствительными и специфичными, нет общепринятого представления о клинической значимости различных тестов. Наиболее удобными для клинического использования и поэтому рекомендованными Всемирной организацией здравоохранения (ВОЗ, 2010) в качестве стандарта являются тесты MAR и IBT. Тест MAR в основном проводится и используется в Европе, тест IBT — в Америке. Эти методы позволяют определить наличие, классы и локализацию ASAT. Тест MAR основан на связывании латексных шариков, покрытых человеческим IgG, со сперматозоидами, покрытыми ACAT, после добавления двухвалентной антисыворотки к Fc-фрагменту человеческого IgG (рис. 1).
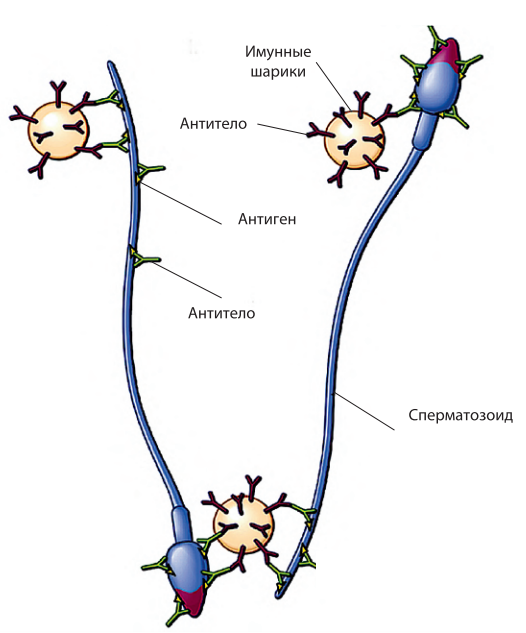
Рис. 1. Принцип реализации прямых методов определения ACAT на сперматозоидах (по данным CCF, 2009)
Используя фазово-контрастный микроскоп с 400-кратным увеличением, подсчитывают долю подвижных сперматозоидов, связанных с гранулами, и локализуют прикрепление гранул. Результат выражается в% MAR для IgG или IgA соответственно. Однако с помощью этих методов невозможно оценить количество ACAT, связанного с поверхностью сперматозоидов. Кроме того, их нельзя использовать при отсутствии активно подвижных сперматозоидов. В этом случае необходимо использовать непрямой метод с инкубацией в семенной плазме донорских сперматозоидов.
По нашему мнению, рекомендуемые в настоящее время рекомендации ВОЗ (2010 г.) с допустимыми уровнями MAR-IgG ниже 50% слишком либеральны и не соответствуют реальной клинической практике. Чтобы уточнить допустимые количества ACAT в сперматозоидах, мы оценили результаты теста MAR у фертильных мужчин с нормозооспермией и показали, что MAR-IgG превышал 10% в 13% случаев, MAR-IgG превышал 50% в 2 случаях. % и MAR-IgG 100% — в 1%. Распределение значений теста MAR в этой группе достоверно отличалось от нормы: медиана — 0% (среднее значение — 5,4 ± 13,8); 50% значений (25-75% перцентиль) находились в диапазоне от 0 до 3%, 95% перцентиль составляли 32%. График «Прямоугольник и усы» показывает, что «выбросы» (значения, далекие от медианы и не типичные для этого набора исследований) были MAR-IgG более 12% (рис. 2). Таким образом, эталонные значения для фертильных мужчин находятся в диапазоне MAR-IgG от 12 до 32%.
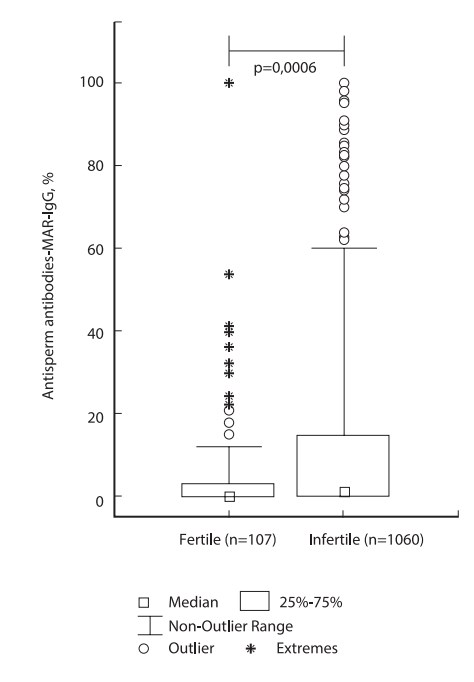
Рис. 2. Результаты прямой идентификации класса ACAT IgG на поверхности подвижных сперматозоидов у фертильных и бесплодных пациентов с нормозооспермией (по В.А. Божедомову и др. п. Reproduct. Immunol. 2015; 112: 95-101)
Поскольку спермиографические показатели, ни по отдельности, ни в целом, не обладают прогностической способностью в отношении наличия или отсутствия аутоиммунных реакций против сперматозоидов, исследования ACAT следует проводить во всех случаях бесплодного брака и замороженных беременностей на ранних стадиях.
Уход
Лечение пациентов с иммунным бесплодием — сложная проблема. Используются несколько стратегий:
- методы снижения продукции ASAT у мужчин;
- методы профилактики иммунных реакций женщины на сперму;
- методы удаления ACAT, уже связанных со сперматозоидами, in vivo и in vitro;
- АРТ, например ЭКО и ПЭ, включая ИКСИ.
Каждый из этих методов в некоторой степени снижает вредное воздействие «мужских» и «женских» ACAT на половые клетки, что приводит к улучшению функции гамет и способствует восстановлению фертильности. Однако все эти методы неспецифичны, поскольку антигены сперматозоидов, которые стимулируют иммунную систему и приводят к иммунологическому бесплодию, остаются неизвестными.
Этиотропное лечение. Первым этапом лечения мужчин с иммунным бесплодием является устранение всех возможных этиологических факторов развития аутоиммунного процесса в их репродуктивной системе: непроходимость семявыносящего протока, урогенитальные инфекции, варикоцеле, перегревание и т.д.
Вопрос о возможности «возвращения» фертильности после микрохирургического восстановления проходимости семявыносящего протока до сих пор остается неясным: сперматозоиды в эякуляте после этой операции появляются у 65-80% пациентов, а у 40-60% — нет аномалии спермограммы и стойкое сохранение АСАТ в 33-60% случаев. Прогноз беременности после реконструктивной хирургии в значительной степени зависит от продолжительности непроходимости и исходного уровня ASAT.
Хирургическое лечение варикоцеле, осложненного АСАТ, имеет менее оптимистичный прогноз. Наши исследования показывают, что у пациентов с АСАТ после микрохирургической варикоцелэктомии наблюдается незначительное увеличение концентрации, подвижности и доли морфологически нормальных форм; доля ASAT-положительных сперматозоидов в среднем не снижается; реже наступают беременности. Результаты операции менее оптимистичны при небольшой степени варикоцеле и значительном количестве АСАТ.
Наш опыт подтверждает важность профилактики и своевременного лечения острых и подострых воспалительных процессов в репродуктивном тракте. При MAR-IgG от 10 до 49% лечение C trachomatis приводит через 2-4 недели к снижению доли MAR-положительных сперматозоидов у 85% пациентов в среднем по группе на 13% в абсолютном выражении. При MAR-IgG более 50%, несмотря на отсутствие C trachomatis в мазках у всех пациентов в первый месяц после терапии и этиологического лечения, почти в 70% случаев через 2 месяца доля IgG-сперматозоидов в этой группе мужчин не претерпели значительных изменений… Только 20% мужчин показали положительную динамику АСАТ.
В целом есть основания полагать, что в большинстве случаев нормализация кровообращения, отсутствие ИРТ, восстановление проходимости (когда это возможно), устранение производственных рисков не обеспечивают исчезновение АСАТ при их наличии производство началось. Эти факторы часто играют роль триггеров, запускающих каскад аутоиммунных реакций при наличии генетической и иммунологической предрасположенности. Поэтому второй этап обычно требует применения дополнительных лечебных мероприятий: фармакотерапии, специальных промываний с последующим внутриматочным введением или введением ЭКО и ПЭ.
Патогенетическое лечение. Использование глюкокортикостероидов (ГКС) по-прежнему является классической терапией для пациентов с заболеваниями, патогенез которых, как предполагается, имеет иммунологический механизм развития. За четыре десятилетия использования этих препаратов примерно одинаковое количество авторов сообщали о случаях успеха и неудач при использовании различных препаратов ГКС. По нашему мнению, ГКС могут быть показаны только пациентам с хроническим простатитом 3А и ACAT: гнойно-спермия без диагностированных инфекций.
Поскольку повреждение сперматозоидов в присутствии ACAT связано с OS сперматозоидов, антиоксиданты можно использовать для лечения мужчин с иммунным бесплодием. 3-гидрокси-6-метил-2-этилпиридина гидрохлорид, рекомендованный для лечения пациентов с воспалительными и дегенеративно-дистрофическими процессами в офтальмологии, доказал свою эффективность при мужском иммунном бесплодии (наш патент на изобретение № 2421220).
У нас есть обнадеживающие результаты с использованием ферментов. Было показано, что почти у всех пациентов, получавших комплекс протеолитических ферментов (панкреатин, трипсин, химотрипсин, бромелайн, папаин) в общей суточной дозе 35-90 мг / кг, снижалась вязкость сперматозоидов, у 3/4 мужчин улучшалась подвижность сперматозоидов, 2 / 3 их концентрация увеличена. Уменьшение количества АСАТ-положительных сперматозоидов произошло у 80% мужчин в среднем на 20-30% (патент РФ № 2149021). Недавно коллеги предложили использовать для этих целей конъюгат протеолитического фермента гиалуронидазы с высокомолекулярным вектором группы N-оксидных производных поли-1,4-этиленпиперазина: по их данным, это помогает также снизить количество ACAT-положительные сперматозоиды. Протеолитические ферменты можно комбинировать с антиоксидантами, рибоксином и другими лекарствами для повышения эффективности лечения.
Еще одним направлением консервативного лечения мужчин с иммунным бесплодием следует считать использование продуктов фетоплацентарного происхождения. Известно, что ряд белков, в значительных количествах вырабатываемых плодом и плацентой во время беременности, такие как лиганд Fas (CD95), α-фетопротеин, α2-микроглобулин фертильности и т.д., обеспечивают иммуносупрессию, необходимую для поддержания и нормальное течение беременности. Применение фетоплацентарных комплексов у мужчин с иммунным бесплодием позволило снизить уровни ACAT на 27-95%, в том числе IgA, которые не реагируют на медикаментозную терапию, для улучшения качества спермы; в каждом четвертом случае забеременели их жены (патент на изобретение №2155596).
Симптоматическое лечение. Использование АРТ в виде ИКСИ следует считать симптоматическим методом. Этот метод позволяет доставлять сперму, часто неспособную к оплодотворению самостоятельно, непосредственно в яйцеклетку. Согласно метаанализу A. Zini et al. (2011), доля беременностей после ИКСИ у пациенток с иммунным бесплодием статистически не отличается от таковой у пациенток с аналогичной спермограммой без АСАТ, но данные о родах не приводятся.
Следует помнить, что разные методы лечения не исключают друг друга. Медикаментозную терапию следует сочетать с внутриматочной инсеминацией, эффективность которой можно повысить с помощью новых методов подготовки спермы. В наиболее сложных случаях при посттравматической атрофии яичек концентрация сперматозоидов менее 5 млн / мл, уровень гонадотропинов в 1,5 раза выше нормы или при наличии дополнительных факторов бесплодия ЭКО и ЭП (ИКСИ) следует рассматривать с самого начала.
