- Матка и яичники
- Репродуктивная система
- Беременность
Содержание
- 1 1. Общие сведения
- 2 2. Причины
- 3 3. Симптомы и диагностика
- 4 4. Лечение
- 5 Синдром Ашермана
- 6 Классификация синдрома Ашермана
- 7 Заболеваемость
- 8 Внутриматочные синехии и беременность
- 9 Причины образования внутриматочных синехий
- 10 Симптомы синдрома Ашермана
- 11 Диагностика синдрома Ашермана
- 12 Лечение синдрома Ашермана (внутриматочных синехий)
- 13 Прогноз при лечении синдрома Ашермана
- 14 Профилактика синдрома Ашермана
- 15 Эндокринные расстройства в репродуктивном периоде
- 16 ДИСФУНКЦИОНАЛЬНЫЕ МАТОЧНЫЕ КРОВОТЕЧЕНИЯ РЕПРОДУКТИВНОГО ПЕРИОДА
- 17 АМЕНОРЕЯ
- 17.0.0.1 ЭПИДЕМИОЛОГИЯ
- 17.0.0.2 КЛАССИФИКАЦИЯ
- 17.0.0.3 Первичная аменорея с задержкой полового развития
- 17.0.0.4 ДИАГНОСТИКА
- 17.0.0.5 ПОРОКИ РАЗВИТИЯ ГОНАД — ДИСГЕНЕЗИЯ ГОНАД
- 17.0.0.6 ПАТОГЕНЕЗ
- 17.0.0.7 КЛИНИЧЕСКАЯ КАРТИНА
- 17.0.0.8 ДИАГНОСТИКА
- 17.0.0.9 ЛЕЧЕНИЕ
- 17.0.0.10 НАРУШЕНИЯ ФУНКЦИИ ГИПОТАЛАМОГИПОФИЗАРНОЙ СИСТЕМЫ
- 17.0.0.11 ФУНКЦИОНАЛЬНЫЕ НАРУШЕНИЯ ГИПОТАЛАМОГИПОФИЗАРНОЙ СИСТЕМЫ
- 17.0.0.12 Клиническая картина
- 17.0.0.13 Диагностика
- 17.0.0.14 ОРГАНИЧЕСКИЕ НАРУШЕНИЯ ГИПОТАЛАМОГИПОФИЗАРНОЙ СИСТЕМЫ
- 17.0.0.15 Клиническая картина
- 17.0.0.16 Диагностика
- 17.0.0.17 Первичная аменорея без задержки полового развития
- 17.0.0.18 Пороки развития половых органов:
- 17.0.0.19 АПЛАЗИЯ МАТКИ (СИНДРОМ МАЙЕРА-РОКИТАНСКОГО-КЮСТНЕРА)
- 17.0.0.20 Клиническая картина
- 17.0.0.21 Инструментальные исследования
- 17.0.0.22 ПАТОЛОГИЯ МАТКИ
- 17.0.0.23 АТРЕЗИЯ ЦЕРВИКАЛЬНОГО КАНАЛА
- 17.0.0.24 Этиология
- 17.0.0.25 Патогенез
- 17.0.0.26 Клиническая картина
- 17.0.0.27 ВНУТРИМАТОЧНЫЕ СИНЕХИИ (СИНДРОМ АШЕРМАНА)
- 17.0.0.28 Клиническая картина
- 17.0.0.29 ФУНКЦИОНАЛЬНЫЕ НАРУШЕНИЯ ГИПОТАЛАМОГИПОФИЗАРНОЙ СИСТЕМЫ
- 17.0.0.30 АМЕНОРЕЯ НА ФОНЕ ПОТЕРИ МАССЫ ТЕЛА
- 17.0.0.31 Патогенез
- 17.0.0.32 Клиническая картина
- 17.0.0.33 Инструментальные исследования
- 17.0.0.34 ПСИХОГЕННАЯ АМЕНОРЕЯ
- 17.0.0.35 ГИПЕРПРОЛАКТИНЕМИЯ
- 17.0.0.36 Этиология
- 17.0.0.37 Клиническая картина
- 17.0.0.38 Диагностика
- 17.0.0.39 Инструментальные исследования:
- 17.0.0.40 ЯИЧНИКОВЫЕ ФОРМЫ ВТОРИЧНОЙ АМЕНОРЕИ
- 17.0.0.41 СИНДРОМ РЕЗИСТЕНТНЫХ ЯИЧНИКОВ
- 17.0.0.42 Этиология и патогенез
- 17.0.0.43 Клиническая картина
- 17.0.0.44 Инструментальные исследования
- 17.0.0.45 СИНДРОМ ИСТОЩЕНИЯ ЯИЧНИКОВ
- 17.0.0.46 Клиническая картина
- 17.0.0.47 Лабораторные исследования
- 17.0.0.48 СИНДРОМ ГИПЕРТОРМОЖЕНИЯ ЯИЧНИКОВ
- 17.0.0.49 Этиология и патогенез
- 17.0.0.50 Клиническая картина
- 18 СИНДРОМ ПОЛИКИСТОЗНЫХ ЯИЧНИКОВ
- 19 МЕТАБОЛИЧЕСКИЙ СИНДРОМ
- 20 ПРЕДМЕНСТРУАЛЬНЫЙ СИНДРОМ
- 21 СИНДРОМ ПОСЛЕ ТОТАЛЬНОЙ ОВАРИЭКТОМИИ
- 22 ПОСТГИСТЕРЭКТОМИЧЕСКИЙ СИНДРОМ
1. Общие сведения
Слово «синехия» (от греческого «неразрывная связь», адгезия, коллагеновая нить) относится к адгезии и последующему слиянию, которое происходит между двумя поверхностями, которые обычно должны оставаться отдельными. В гинекологии, в частности, довольно часто наблюдаются синехии малых половых губ, которые развиваются у девочек 1-2 лет, в остальном здоровых — такие пленочные спайки в большинстве случаев протекают бессимптомно и разрешаются спонтанно, без специального вмешательства, на фоне правильные гигиенические процедуры.
Внутриутробные синехии, или синдром Ашермана, конечно, более серьезная патология. Помимо болезненного дискомфорта и других клинических симптомов, снижающих качество жизни, внутриутробные синехии могут значительно ухудшить репродуктивную функцию. В специальных источниках приводятся эпидемиологические данные, согласно которым более половины случаев женского бесплодия вызваны синдромом Ашермана.
2. Причины
Одно из синонимичных названий синдрома Ашермана — травматическая аменорея. Поэтому подчеркивается наиболее значимый из всех этиопатогенетических факторов, а именно травма эндометрия матки при искусственном прерывании беременности, диагностическое выскабливание, хирургические вмешательства и использование внутриматочной контрацепции. Еще одним провокатором спаечного процесса являются инфекции, приводящие к эндометриту (воспалению внутренней оболочки матки). Женщины с историей потерянных беременностей также подвержены риску; по разным оценкам внутриматочные синехии разной степени выраженности обнаруживаются у 10-40% пациенток после повторных самопроизвольных абортов.
3. Симптомы и диагностика
Различные классификации отражают широкую вариативность клинической картины синдрома Ашермана. Таким образом, по объему спаечного процесса различают три степени: от единичных тонких синехий, не перекрывающих устье маточных труб, до множественных спаек, охватывающих более 75% полости матки.
Также существуют разные степени по биофизическим характеристикам синехий, сохранению менструальной функции, вовлечению эндометрия, степени облитерации области трубных отверстий: от синехий до удерживаемых и легко подавляемых телом гистероскопа. — к грубым плотным спайкам соединительной ткани в сочетании с массивным фиброзом эндометрия и тотальной аменореей.
Поэтому основными симптомами являются нарушения менструального цикла и репродуктивной функции. Некоторые пациентки испытывают мучительную боль внизу живота, которая усиливается в дни менструации. Возможны также бессимптомные варианты течения.
Риски, связанные с наличием нелеченных внутриматочных синехий, более или менее поровну делятся на три части: у более 30% пациенток впоследствии возникают выкидыши, такая же вероятность преждевременных родов и с такой же частотой у этой категории беременных женщин прикрепление толстой или плаценты происходит предлежание.
Стандартным диагностическим стандартом при подозрении на синдром Ашермана сегодня является гистероскопия. При остаточных сомнениях рекомендуется назначить гистеросальпингографическое исследование с рентгеноконтрастом, методическим недостатком которого, однако, является определенная вероятность ложноположительного результата. Ультразвуковые исследования при всех их достоинствах в данном случае малоинформативны.
При появлении признаков вторичной инфекции проводится бактериологический или серологический анализ.
4. Лечение
Консервативной терапии внутриутробных синехий не существует. Радикальным решением проблемы является хирургическое рассечение спаек трансцервикальным доступом под эндоскопическим (гистероскопическим) контролем. В дальнейшем назначают гормональную поддержку эстрогеном для восстановления нормального эндометрия, а также практикуют введение дополнительных приспособлений в матку, чтобы избежать рецидива.
Эффективность такого вмешательства достаточно высока, но критически зависит от стадии и степени тяжести фиброзно-спаечного процесса: чем больше игнорируется ситуация, тем ниже шансы на восстановление функций. В среднем процент случаев, в которых репродуктивная функция может быть восстановлена хирургическим путем, сейчас оценивается в 80-90%, но на самом деле беременность наступает с вероятностью 30-70% (большой разброс объясняется вариабельностью индивидуальных особенностей.). Однако следует четко понимать: биологическая (теоретическая) фертильность не гарантирует фактического зачатия, а наступление беременности не гарантирует успешной беременности и нормальных родов. Перечисленные выше риски остаются высокими, как и риск повторного образования внутриутробных синехий. И поэтому гинекологи снова и снова предупреждают, что любое механическое вмешательство в полость матки может рассматриваться только как крайняя, абсолютно необходимая мера, что аборт крайне опасен и никогда не станет «рутинной» процедурой, что секс следует беречь, а планирование беременности должно быть значимым и очень рано.
Синдром Ашермана
Синдром Ашермана, или внутриутробные синехии, — это патологическое состояние, характеризующееся образованием спаек и разрастаний эндометрия с его склерозом и фиброзом. Заболевание также известно как синдром Фрича, травматическая атрофия эндометрия или склероз эндометрия. Заболевание названо в честь гинеколога, подробно описавшего и изучившего данную патологию, Джозефа Ашермана. Впервые синдром был описан в 1894 году немецким гинекологом Генрихом Фричем.
- Классификация синдрома Ашермана
- Заболеваемость
- Внутриутробные синехии и беременность
- Причины образования внутриутробных синехий
- Симптомы синдрома Ашермана
- Диагностика синдрома Ашермана
- Лечение синдрома Ашермана (внутриматочные синехии)
- Прогноз при лечении синдрома Ашермана
- Профилактика синдрома Ашермана
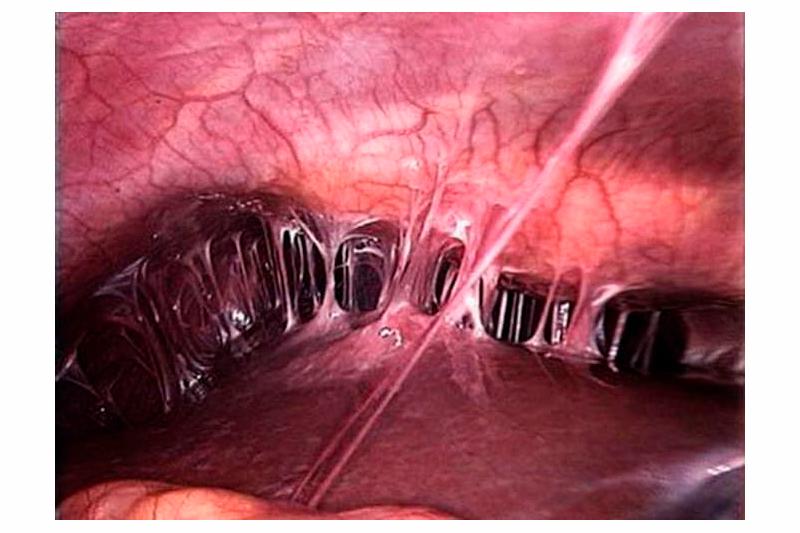
Классификация синдрома Ашермана
В зависимости от степени поражения базального слоя эндометрия спаечные процессы могут быть разного характера и длины. В основном различают 3 степени тяжести заболевания:
- легкая степень — спайки состоят из тонкой ткани базального слоя, легко разрушаются при контакте с рабочей частью эндоскопа, занимают менее 25% полости матки;
- средняя степень: фиброзно-мышечные спайки, плотно прилегающие к слизистой оболочке матки, занимают большую часть полости матки;
- тяжелая — плотные спайки, состоящие из склерозированной соединительной ткани, заполняют более 75% полости матки, закупоривают устье маточных труб, дно матки.
Заболеваемость
Синдром Ашермана встречается у женщин всех рас с одинаковой частотой. После выскабливания полости матки у рожавших женщин риск развития заболевания составляет 25%. Неразвивающаяся или замершая беременность часто приводит к возникновению данной патологии и составляет до 30% случаев. При обычном невынашивании беременности с задержкой частей плодных оболочек и последующим выскабливанием риск заболевания не превышает 7%.
Чем дольше период задержки плодных оболочек после родов или выкидыша, тем больше вероятность заболевания. Также важно количество процедур: после однократного выскабливания риск составляет 16%, а 3 и более процедур увеличивают вероятность синдрома Ашермана до 32%.
Внутриматочные синехии и беременность
При синдроме Ашермана серьезно нарушается репродуктивная функция. Из-за синехий полость матки облитерируется, и проходимость маточных труб нарушается. В тяжелых случаях вся полость матки закупоривается спайками, стенки сходятся, что приводит к невозможности зачатия и имплантации эмбриона. Кроме того, эндометрий теряет способность реагировать на циклические колебания уровня эстрогенов, в результате чего возникает вторичное бесплодие и возможна аменорея, то есть отсутствие менструации.
Синехии в шейном отделе приводят к скоплению и задержке менструальных выделений в полости матки. Об этом свидетельствует боль и малые выделения во время менструации (олигоменорея). Любые нарушения менструального цикла обычно указывают на тяжелую форму заболевания.
В зависимости от тяжести заболевания влияние на репродуктивную функцию может варьироваться от осложненного течения беременности до повторных выкидышей, выкидышей и вторичного бесплодия. Возможны преждевременные роды, разрыв матки на поздних стадиях, истинный рост плаценты и другие патологии беременности.
Причины образования внутриматочных синехий
Матка — полый мышечный орган, состоящий из 3-х слоев. Снаружи она покрыта брюшиной. Стенка матки состоит из гладкой мышечной ткани. Полость матки выстилает эндометрий, который состоит из поверхностного и глубокого функциональных базальных слоев. Эндометрий под действием женских половых гормонов претерпевает циклические изменения в зависимости от фазы менструального цикла. Ближе к стадии овуляции, когда вероятность зачатия выше, слизистая оболочка матки утолщается. В клетках эндометрия происходит активный синтез питательных и биологически активных веществ. При попадании оплодотворенной яйцеклетки происходит имплантация: зародыш погружается в толщу слизистой оболочки матки. Контакт мембран эмбриона с нормальным эндометрием — важное условие для хорошего начала беременности. Если беременность не наступила, функциональный слой полностью отторгается во время менструации. С началом нового цикла он снова начинает расти, регенерируя себя с помощью стволовых клеток из базального слоя.
Внутриутробные синехии — это разрастания или спайки склерозированного эндометрия, которые изменяют нормальную анатомию и физиологию слизистой оболочки матки.
Основная причина синдрома Ашермана — повреждение и травма базального слоя при гинекологических процедурах (дилатация полости матки, лечебно-диагностическое выскабливание полости матки, кесарево сечение, операции на матке). Реже внутриутробные синехии образуются после эндометрита — воспаления слизистой оболочки матки.
Симптомы синдрома Ашермана
Клиника синдрома Ашермана обычно не влияет на общее состояние и самочувствие пациентов. Основные симптомы связаны со спаечным процессом и его влиянием на функцию репродуктивной системы. Среди них:
- Альгодисменорея, то есть нарушение менструальной функции: длительные, обильные или редкие болезненные периоды.
- Олигоменорея, гипоменорея, в тяжелых случаях аменорея: уменьшение количества и продолжительности менструаций.
- Гематометра, или гематосальпинкс, представляет собой скопление менструальных выделений в полости матки или маточных трубах из-за спаек в шейной области, которые блокируют цервикальный канал. В результате возможен сильный болевой синдром, возникающий во время менструации. Попадание крови по маточным трубам в брюшную полость вызывает сильную боль, похожую на изображение острого живота.
- Привычный выкидыш, повторные беспричинные выкидыши, вторичное бесплодие.
Синдром Ашермана может сопровождаться эндометриозом (аденомиозом) различной степени тяжести. Эндометриоз — это внематочное разрастание функционального слоя эндометрия вне полости матки. Эта комбинация ухудшает прогноз и перспективы лечения и сильнее влияет на репродуктивную функцию.
Диагностика синдрома Ашермана
В основном для диагностики используются инструментальные методы исследования, которые позволяют осмотреть полость матки изнутри. Чтобы смотреть в правильном направлении, необходимо учитывать данные акушерского анамнеза: количество беременностей, родов, выкидышей и других медицинских процедур.
Ультразвук традиционно считается самым дешевым и неинвазивным методом исследования органов малого таза. Более информативный вариант УЗИ — трансвагинальное УЗИ. Для точного диагноза необходимо провести исследование на разных этапах менструального цикла.
Золотым стандартом диагностики внутриматочных синехий является эндоскопическое исследование полости матки или гистероскопия. Эндоскоп вводится в полость матки через цервикальный канал, что позволяет видеть состояние эндометрия в реальном времени на мониторе. Кроме того, диагностическая гистероскопия может предшествовать прямой эндоскопической операции по удалению спаек. Это лучший способ оценить распространенность процесса и определить характер спаек и возможность их удаления.
В некоторых случаях проводится гистеросальпингография. Этот метод в основном используется для оценки проходимости маточных труб.
Результаты исследования необходимо объединить с данными клиники, предыдущих попыток лечения и акушерского анамнеза, что позволяет прогнозировать результаты и эффективность лечения.
Лечение синдрома Ашермана (внутриматочных синехий)
Заболевание легкой и средней степени тяжести обычно хорошо поддается лечению. В тяжелых случаях синдром Ашермана и связанное с ним бесплодие можно преодолеть только с помощью суррогатного материнства. В некоторых случаях (когда синехии расположены на ограниченном участке матки) экстракорпоральное оплодотворение оказывается эффективным.
Удаление (рассечение) синехий проводится методом оперативной гистероскопии. Метод не требует общей анестезии и не вызывает осложнений, характерных для обычных операций. Микроинструменты можно пропустить через каналы эндоскопического блока. Удаление и рассечение синехий микроножницами выполняется с осторожностью из-за вероятности дальнейшего повреждения. Особую опасность представляет перфорация стенки матки во время операции. Технически это непростая задача. В тяжелых случаях синехии заполняют всю полость матки, плотно прикрепляются к стенкам и при рассечении кровоточат.
Частота рецидивов высока. У некоторых пациентов внутриматочные спайки снова появляются после хирургического лечения. Для предотвращения рецидива после операции в полость матки вводят желатиновые наполнители, предотвращающие соприкосновение стенок и образование спаек. Средняя частота рецидивов после операции составляет 28%.
В послеоперационном периоде назначают антибиотики для предотвращения инфекционных осложнений. Медикаментозное лечение в послеоперационном периоде необходимо дополнять гормональной терапией. Циклическое введение эстрогена и прогестагена проводится для стимуляции роста эндометрия.
Через некоторое время после операции проводится повторная гистероскопия для оценки результатов лечения и своевременной диагностики рецидива.
Прогноз при лечении синдрома Ашермана
Средняя эффективность лечения связана с частотой наступления беременности. При легкой степени заболевания беременность наблюдается у 93% пациенток, при средней степени — у 78%. Лечение тяжелой степени синдрома Ашермана позволяет забеременеть 57% женщин. Однако рождение здорового ребенка наблюдается в 81, 66 и 32% случаев соответственно степени тяжести заболевания.
Возраст пациентов также имеет прогностическое значение. 66% женщин в возрасте до 35 лет с тяжелым синдромом Ашермана могут зачать ребенка после лечения. Однако для женщин старше 35 лет этот показатель не превышает 24%.
Профилактика синдрома Ашермана
Выскабливание полости матки острой гинекологической кюреткой или вакуум-аспирация — процедуры, выполняемые практически вслепую, врач во время манипуляций полагается только на собственные ощущения. Ткань эндометрия под действием эстрогенов при беременности мягкая и легко повреждается. Следовательно, лечебное или диагностическое выскабливание практически всегда сопровождается тем или иным повреждением базального слоя эндометрия.
Альтернативой кюретажу при выкидышах или невынашивании беременности является использование лекарств для стимуляции родов (терапевтический аборт). Однако эффективность этого метода составляет 80-85%. В 10-15% случаев после терапевтического аборта откладываются части плодных оболочек, что снова требует выскабливания.
Возможно, безопасность и эффективность лечебно-диагностического выскабливания полости матки можно повысить, если проводить процедуру под контролем УЗИ.
Эндокринные расстройства в репродуктивном периоде
Оглавление:
Дисфункциональные маточные кровотечения репродуктивного периода
Аменорея
Синдром поликистозных яичников
Метаболический синдром
Предменструальный синдром
Синдром после тотальной овариэктомии
Постгистерэктомический синдром
ДИСФУНКЦИОНАЛЬНЫЕ МАТОЧНЫЕ КРОВОТЕЧЕНИЯ РЕПРОДУКТИВНОГО ПЕРИОДА
Дисфункциональное маточное кровотечение — ановуляторное кровотечение, вызванное нарушением функции яичников. В репродуктивном периоде частота дисфункциональных маточных кровотечений непостоянна и колеблется от 10% до 37%.
ЭТИОЛОГИЯ
Причинами дисфункции яичников в репродуктивном периоде являются различные факторы окружающей среды: стресс, инфекции, хирургическое вмешательство, травма, прерывание беременности, метаболический синдром, прием лекарств и т.д.
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина характеризуется обильным кровотечением более 7 дней, которое возникает после задержки менструации на 1,5-3 месяца. Реже дисфункциональное маточное кровотечение протекает как меномероррагия, когда незначительное кровотечение продолжается после обильной менструации. Об интенсивности кровотечения можно судить по наличию или отсутствию сгустков. Симптомы также определяются тяжестью постгеморрагической анемии и характеризуются бледностью кожи, тахикардией, слабостью, головокружением и сонливостью. При незначительном кровотечении немного страдает общее самочувствие.
Инструментальная диагностика
УЗИ позволяет исключить подслизистые миомы, полипы, внутренний эндометриоз. Наиболее информативной является гистероскопия, которая проводится в условиях стационара во время раздельного лечебно-диагностического выскабливания с последующим гистологическим исследованием удаленного эндометрия.
АМЕНОРЕЯ
Аменорея — это отсутствие менструации в течение 6 месяцев и более. Аменорея — не самостоятельное заболевание, а симптом не только патологии различных уровней репродуктивной системы, но и других нейроэндокринных заболеваний, доброкачественных и злокачественных новообразований.
ЭПИДЕМИОЛОГИЯ
Частота аменореи у женщин репродуктивного возраста составляет около 1,8-3,5%, у студенток 3,5-5% и в структуре нарушений менструальной и генеративной функции 10-15%. Первичная аменорея встречается гораздо реже, чем вторичная, и составляет около 10% структуры аменореи.
КЛАССИФИКАЦИЯ
Аменорея делится на первичную и вторичную. Первичная аменорея — менструации не было. Вторичная аменорея — это отсутствие менструации в течение 6 месяцев и более после периода регулярных или нерегулярных менструаций. Первичная аменорея может протекать с нарушением развития вторичных половых признаков или без такового. Вторичная аменорея возникает на фоне нормального развития вторичных половых признаков.
Первичная аменорея с задержкой полового развития
Первичная аменорея — это отсутствие менструации с момента полового созревания, то есть никогда не было ни одной менструации.
ДИАГНОСТИКА
В первую очередь нужно иметь четкое представление о том, когда начинать обследование девушек при отсутствии менструации:
- отсутствие менархе (первой менструации) в возрасте 16 лет и старше;
- отсутствие признаков полового созревания (молочные железы, половой рост волос) в возрасте 14 лет и старше;
- отсутствие менархе в течение 3 лет и более от начала и развития вторичных половых признаков;
- несоответствие показателей роста и массы тела хронологическому возрасту (или несоответствие биологического возраста календарному).
ПОРОКИ РАЗВИТИЯ ГОНАД — ДИСГЕНЕЗИЯ ГОНАД
Дисгенезия гонад — это врожденная патология, при которой из-за хромосомных аномалий отсутствует ткань яичника, вырабатывающая функционально активные гормоны. Дисгенезия гонад — наиболее частая причина (30-43%) среди всех форм первичной аменореи на фоне отсутствия вторичных половых признаков.
ПАТОГЕНЕЗ
Для развития яичников необходимо наличие двух половых Х-хромосом, то есть женский кариотип — 46, ХХ. Во время мейотического деления половых клеток может возникнуть аномальный набор половых хромосом. Когда эти половые клетки сливаются, патологический набор хромосом попадает в оплодотворенную яйцеклетку. Хромосомные дефекты могут быть количественными: отсутствие хромосомы (моносомия 45, X), удвоение или утроение количества хромосом (полисомия 47, XXX или 47, XXY). Формирование мозаичных наборов хромосом возможно, когда клоны клеток имеют другой набор хромосом.
КЛИНИЧЕСКАЯ КАРТИНА
Клиническая картина характеризуется первичной аменореей и вариабельностью симптомов. Внешний вид пациентов описан в разделе «задержка полового созревания».
ДИАГНОСТИКА
- Определение гормонов в сыворотке крови.
- Генетическая экспертиза.
- Гормональный тест с гестагенами.
- Инструментальные исследования
- При УЗИ яичники определяются в виде соединительнотканных тяжей длиной 1-1,5 см, шириной 0,3-0,5 см при отсутствии фолликулов, эндометрий линейный, размеры матки уменьшаются.
Следовательно, различные формы дисгенезии гонад обусловлены мозаичным кариотипом и различаются особенностями клинической картины. Но для всех форм данной патологии существуют общие диагностические критерии:
- первичная аменорея;
- отсутствие или сильное недоразвитие вторичных половых признаков, генитальный инфантилизм;
- Ультразвуковые признаки дисгенетических гонад;
- высокий уровень гонадотропинов, особенно ФСГ, соответствующий возрасту постменопаузы;
- кариотип с аномальным набором половых хромосом, отсутствием или значительным снижением полового хроматина;
- отрицательный тест на гестагены, но положительный на эстрогены и гестагены.
ЛЕЧЕНИЕ
Лечение дисгенезии гонад зависит от наличия хромосомы в кариотипе. В связи с высоким риском возникновения новообразований гонад, если они есть, необходимо как можно скорее удалить их эндоскопическим доступом в возрасте 20 лет. При отсутствии хромосомы в кариотипе или после хирургического удаления гонад проводится заместительная гормональная терапия, которая направлена на:
- феминизация фигуры, развитие полового роста волос, молочных желез, матки;
- подавление уровня гонадотропинов;
- развитие циклических изменений эндометрия с менструальной реакцией;
- профилактика состояний дефицита эстрогенов (остеопороз, нарушения обмена веществ, сердечно-сосудистые заболевания);
- социальная адаптация;
- улучшение качества жизни.
НАРУШЕНИЯ ФУНКЦИИ ГИПОТАЛАМОГИПОФИЗАРНОЙ СИСТЕМЫ
Все эти формы первичной аменореи характеризуются низким содержанием гонадотропинов, поэтому их еще называют гипогонадотрофами. Их частота в структуре первичной аменореи составляет 25-40%.
ФУНКЦИОНАЛЬНЫЕ НАРУШЕНИЯ ГИПОТАЛАМОГИПОФИЗАРНОЙ СИСТЕМЫ
Эта форма аменореи сопровождается ZPR (задержкой полового развития) и может быть результатом недоедания, хронических инфекций, интоксикаций, заболеваний почек и печени, анемии и других эстрогенных патологий.
Около 10-14% функциональных причин нарушений гипоталамо-гипофизарной системы составляют конституциональные формы CR, часто передающиеся по наследству. При этой форме первичной аменореи пубертатный период как бы сдвигается по времени на более поздний срок. Развитие молочных желез, волос на половых органах и менархе происходит в возрасте старше 16 лет. Такая задержка полового созревания характерна для народов, населяющих северные районы, имеет конституциональный характер, который, очевидно, связан с климатическими, диетическими факторами и имеет наследственную природу.
Клиническая картина
Клиническая картина характеризуется отсутствием менструации, недоразвитием вторичных половых признаков, генитальным инфантилизмом. Других жалоб у пациента нет.
Диагностика
Наиболее информативным является определение в крови гонадотропинов (ЛГ и ФСГ), уровень которых соответствует периоду полового созревания. Диагностическое значение имеет определение костного возраста по рентгенологическому изображению костей кисти, запястья и нижней трети предплечья. Костный (или биологический) возраст при этой форме CRA отстает от календарного на 2-4 года. При УЗИ эндометрий линейный, матка небольших размеров.
ОРГАНИЧЕСКИЕ НАРУШЕНИЯ ГИПОТАЛАМОГИПОФИЗАРНОЙ СИСТЕМЫ
Наиболее частой органической причиной является краниофарингиома, опухоль, развивающаяся из ткани гипофиза. Опухоль доброкачественная, часто кальцифицируется, что облегчает ее диагностику по рентгенограмме черепа.
Клиническая картина
Клиническая картина характеризуется сильными головными болями, неврологической симптоматикой. Лечение своевременное. К редким формам органической патологии гипоталамо-гипофизарной системы относится синдром Каллмана — первичная аменорея в сочетании с аносмией, то есть неспособностью воспринимать запахи. Эта патология генетически детерминирована. Дефектный ген расположен на хромосоме X. Клиническая картина характеризуется инфантилизмом наружных и внутренних половых органов, отсутствием вторичных половых признаков и аносмией.
Все описанные формы клинически однотипны и характеризуются физическим евнухоидом, сильным недоразвитием наружных и внутренних половых органов, отсутствием или сильным недоразвитием вторичных половых признаков. Выяснить причины аменореи помогает наличие таких особых симптомов, как неврологические расстройства и аносмия.
Диагностика
- Лабораторное исследование
- Инструментальные исследования
- При УЗИ размер яичников уменьшается из-за множества мелких антральных фолликулов и отсутствия растущих фолликулов (мультифолликулярных яичников), эндометрий тонкий, размеры матки уменьшены.
Первичная аменорея без задержки полового развития
Пороки развития половых органов:
АПЛАЗИЯ МАТКИ (СИНДРОМ МАЙЕРА-РОКИТАНСКОГО-КЮСТНЕРА)
Аплазия матки — это отсутствие матки, часто сочетающееся с отсутствием влагалища. Нормальный фолликулогенез, синтез стероидов, овуляция и образование желтого тела, как известно, происходят в яичниках. Поэтому нарушения полового развития при этом синдроме нет.
Клиническая картина
Пациентку ничего не беспокоит, кроме отсутствия менструации.
Инструментальные исследования
- УЗИ окончательно подтверждает диагноз, при этом определяется нормальный размер яичников и отсутствие матки.
Вторичная аменорея — это отсутствие менструации в течение 6 месяцев и более после периода нормальной или нерегулярной менструации. При этой форме аменореи нет нарушения развития вторичных половых признаков, так как пубертатный период протекает в соответствующей возрастной группе. В отличие от первичной аменореи вторичная является обычным явлением и составляет до 75% в структуре всех форм аменореи.
ПАТОЛОГИЯ МАТКИ
АТРЕЗИЯ ЦЕРВИКАЛЬНОГО КАНАЛА
Атрезия цервикального канала — это отсутствие менструации из-за травматических внутриматочных манипуляций, выскабливания, при которых повреждается базальная мембрана эндоцервикса. Частота этой формы аменореи составляет около 5-7% в структуре вторичной аменореи.
Этиология
Эта форма аменореи возникает после аборта, выскабливания.
Патогенез
Из-за травмы слизистая оболочка цервикального канала разрушается на базальной мембране, активируются факторы адгезии, что приводит к процессу спаек.
Клиническая картина
Клиническая картина характеризуется отсутствием менструации после операции. Важный симптом — циклические боли из-за нарушения оттока менструальной крови.
ВНУТРИМАТОЧНЫЕ СИНЕХИИ (СИНДРОМ АШЕРМАНА)
Внутриутробные синехии (синдром Ашермана) являются следствием частого и грубого выскабливания или эндометрита. Заболеваемость среди причин вторичной аменореи составляет около 3.
Клиническая картина
В отличие от атрезии цервикального канала, пациент не испытывает циклических болей. Распространенная ошибка практикующих врачей — поиск эндокринных нарушений при аменорее после аборта. Не существует единственного нейроэндокринного синдрома, который мог бы вызвать аменорею после аборта или диагностического выскабливания!
ФУНКЦИОНАЛЬНЫЕ НАРУШЕНИЯ ГИПОТАЛАМОГИПОФИЗАРНОЙ СИСТЕМЫ
АМЕНОРЕЯ НА ФОНЕ ПОТЕРИ МАССЫ ТЕЛА
В структуре вторичной аменореи эта патология достигает до 20-25%.
Причина снижения синтеза и выброса гонадотропных гормонов — голод. Чаще всего эмоционально неуравновешенные девушки 14-18 лет придерживаются низкокалорийной косметической диеты для достижения «идеальной фигуры». Оценить границу между небольшой потерей массы тела, не влияющей на самочувствие, и началом заболевания практически невозможно, так как патологические изменения на фоне голодания развиваются постепенно, а хорошее самочувствие сохраняется на протяжении длительного периода времени много времени. К тому же реакция организма на похудание индивидуальна, и даже небольшая потеря массы тела (на 3-10%) может привести к возникновению болезни.
Патогенез
Патогенетические механизмы развития вторичной аменореи на фоне похудания связаны с нарушением нейроэндокринного контроля синтеза и секреции GnRH (гонадотропин-рилизинг-гормона). В результате снижения его выработки снижается секреция гонадотропинов в гипофизе, поэтому эта форма вторичной аменореи является гипогонадотропной. Определенную роль играет уменьшение количества жировой ткани, являющейся местом внегонадного синтеза половых стероидов. Быстрая потеря 10-15% жировой ткани не только в период полового созревания, но и в постпубертатный период приводит к резкому прекращению менструации.
Клиническая картина
Вторичная аменорея — один из самых явных признаков начала заболевания при соблюдении косметической диеты, из-за чего девушки обращаются к гинекологу. Хотя это всего лишь признак распространенного заболевания, связанного с голоданием. На фоне продолжающегося похудания симптомы голода усиливаются: брадикардия, гипотензия, гипогликемия, переохлаждение, гастрит, запор. В дальнейшем кахексия развивается с полной потерей аппетита и отвращением к пище. Эта симптоматика очень похожа на психическое заболевание: нервную анорексию.
Инструментальные исследования
- При УЗИ яичники нормальных размеров, мультифолликулярные, эндометрий меньше 5 мм, размеры матки уменьшены.
- Прогноз благоприятный для восстановления менструальной и генеративной функции при своевременной диагностике и лечении.
ПСИХОГЕННАЯ АМЕНОРЕЯ
Частота в структуре вторичной аменореи составляет около 4-6%. Вторичная аменорея в репродуктивном возрасте может быть следствием психоэмоциональных расстройств. В качестве примера всегда приводят аменорею военного времени. Клиническая картина характеризуется внезапным прекращением менструации без предварительного периода олигоменореи. Также отсутствуют вегето-сосудистые симптомы, характерные для климакса.
ГИПЕРПРОЛАКТИНЕМИЯ
Гиперпролактинемия — аменорея, связанная с чрезмерной секрецией пролактина, в результате которой снижается синтез гонадотропинов в гипофизе, этот вид аменореи называется гипогонадотропной.
Этиология
Патологическая гиперпролактинемия развивается в результате анатомических или функциональных нарушений гипоталамо-гипофизарного комплекса.
- Опухоли гипофиза (краниофарингиома, глиома, гранулема), опухоли с гормональной активностью (пролактиномы, аденомы гипофиза, секретирующие АКТГ, смешанный пролактин).
- Повреждение гипофиза в результате травмы или операции, черепно-мозговой травмы, лучевого воздействия.
- Функциональные причины.
- Усталость.
- Нейроинфекция (менингит, энцефалит).
- Различные эндокринные заболевания (гипотиреоз, болезнь Кушинга, синдром Нельсона, акромегалия).
Клиническая картина
Клиническая картина характеризуется нарушением менструального цикла, чаще вторичной аменореей. Около 70% пациенток связывают нарушения менструального цикла с ситуациями сильного стресса, травмы, хирургического вмешательства и длительного приема антипсихотических средств. Галакторея (лакторея) от разовых капель молозива до струи молока наблюдается не у всех (около 67%) женщин с гиперпролактинемией. Головная боль (обычно по типу мигрени), головокружение, преходящее повышение артериального давления отмечаются примерно у половины женщин.
Диагностика
Диагностика в основном направлена на выявление опухоли гипофиза. Диагностика микроаденомы гипофиза в настоящее время возможна с помощью КТ или МРТ.
Инструментальные исследования:
- Исследование глазного дна и поля зрения.
- Ультразвуковая диагностика, ТКМС, МРТ.
ЯИЧНИКОВЫЕ ФОРМЫ ВТОРИЧНОЙ АМЕНОРЕИ
СИНДРОМ РЕЗИСТЕНТНЫХ ЯИЧНИКОВ
Синдром резистентных яичников возникает у женщин в возрасте до 35 лет, характеризуется вторичной аменореей, грубыми и микроскопическими изменениями яичников и повышенным уровнем гонадотропинов. Частота синдрома резистентных яичников составляет примерно 5-6% среди всех форм аменореи.
Этиология и патогенез
Причины синдрома резистентных яичников до конца не изучены. Не исключено, что его развитие связано с генетически детерминированными дефектами рецепторного аппарата фолликулов.
Клиническая картина
Клиническая картина характеризуется вторичной аменореей до 35 лет. В анамнезе пациенток с ЭСС наследственная отягощенность менструальных и генеративных нарушений, высокая частота инфекционных и аутоиммунных заболеваний. Начало болезни у пациента связано с тяжелыми вирусными инфекциями, стрессовыми ситуациями. Кроме отсутствия менструации, других жалоб пациентки не предъявляют.
Инструментальные исследования
- При УЗИ определяется нормальный размер яичников с множеством фолликулов диаметром до 5-6 мм; матка нормальных размеров, эндометрий тонкий.
СИНДРОМ ИСТОЩЕНИЯ ЯИЧНИКОВ
Синдром истощения яичников или преждевременная недостаточность яичников — это комплекс симптомов, характеризующийся вторичной аменореей, симптомами дефицита эстрогена (приливы, потливость и т.д.) и повышенным уровнем гонадотропинов (ФСГ и ЛГ) у женщин в возрасте до 40 лет, перенесших нормальные менструальные циклы в прошлом и генеративная функция. Данная патология встречается в 1-3% и занимает до 10% в структуре различных форм аменореи.
Клиническая картина
Клиническая картина, в отличие от синдрома резистентных яичников, характеризуется наличием типичных для постменопаузы вегетативно-сосудистых проявлений: приливов, потливости, слабости, головной боли и т.д. При инвалидности. Возраст менархе своевременный, менструальная и генеративная функции длительное время не нарушаются. Заболевание начинается с аменореи, которой редко предшествует период олигоменореи. Для этих женщин ожирение не характерно. На фоне аменореи прогрессируют атрофические процессы в молочных железах и половых органах.
Лабораторные исследования
Решающая роль принадлежит гормональным исследованиям, в которых определяется значительное повышение уровня гонадотропинов, в частности ФСГ, и резкое снижение уровня эстрадиола. Инструментальные исследования. При трансвагинальном УЗИ яичники уменьшены в размерах, фолликулы отсутствуют, матка меньше нормы, эндометрий линейный.
СИНДРОМ ГИПЕРТОРМОЖЕНИЯ ЯИЧНИКОВ
Для этой формы вторичной аменореи характерно отсутствие менструации после длительного приема препаратов, угнетающих гонадотропную функцию гипофиза. Синдром гиперингибирования яичников — ятрогенное заболевание (врачебная ошибка.
Этиология и патогенез
Угнетение секреции гонадотропов после длительного ее подавления эстроген-прогестагенными препаратами приводит к развитию вторичной аменореи.
Клиническая картина
Клиническая картина характеризуется отсутствием менструации без вегетативно-сосудистых проявлений, характерных для синдрома истощения яичников и ранней менопаузы.
СИНДРОМ ПОЛИКИСТОЗНЫХ ЯИЧНИКОВ
Синдром поликистозных яичников (СПКЯ) — патология строения и функции яичников, характеризующаяся гиперандрогенизмом яичников с нарушением менструальной и генеративной функции.
СИНОНИМЫ
Поликистоз яичников, первичный поликистоз яичников, синдром Штейна-Левенталя, склерополический яичник. Частота данной патологии составляет около 11% среди женщин репродуктивного возраста, в структуре эндокринного бесплодия достигает 70%.
Причина заболевания до конца не выяснена, несмотря на большое количество предложенных теорий. В то же время СПКЯ считается гетерогенным наследственным заболеванием, характеризующимся нарушениями менструального цикла, хронической ановуляцией, гиперандрогенизмом, увеличением размеров яичников и особенностями их морфологического строения: двустороннее увеличение размеров яичников в 2-6 раз, гиперплазия стромы и текцелл, множество кистозно-атрезирующих фолликулов диаметром 5-8 мм, утолщение капсулы яичника. Кардинальный признак СПКЯ — гиперандрогения яичников.
Клиническая картина
Клиническая картина характеризуется нарушениями менструального цикла, первичным бесплодием, чрезмерным ростом волос, угрями. В последние годы женщины с нормальной массой тела и умеренными андрогенозависимыми дерматопатиями, так называемые пациенты без гирсута, встречаются все чаще (около 50%). Менархе своевременный — 12-13 лет. Нарушение менструального цикла с периода менархе по типу олигоменореи у подавляющего большинства женщин (70%), реже дисфункциональные маточные кровотечения (7-9%). Вторичная аменорея (до 30%) возникает у нелеченных женщин старше 30 лет с сопутствующим ожирением, а у пациентов с нормальной массой тела наблюдается при менархе и не зависит от продолжительности ановуляции.
Диагностика
В настоящее время большинство исследователей приняли диагностические критерии, предложенные на Роттердамском консенсусе 2004 года: олигоменорея и / или ановуляция, гиперандрогения (клинические и / или биохимические проявления), ультразвуковые признаки поликистозных яичников.
Наличие двух из этих трех признаков позволяет диагностировать СПКЯ:
- Лабораторное исследование
- Исследование гормонов крови
- Определение инсулинорезистентности
- Общий и биохимический анализ крови, мочи
ИНСТРУМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Важнейшим методом диагностики СПКЯ является ультразвуковое исследование поликистозных яичников.
Экоскопические критерии поликистоза яичников:
- объем яичников более 8 см 3 ;
- увеличение площади гиперэхогенной стромы;
- количество анэхогенных фолликулов диаметром до 10 мм не менее десяти;
- усиление кровотока и обильная сосудистая сеть в строме (с допплером).
Цель обработки:
- восстановление овуляторных менструальных циклов;
- восстановление генеративной функции;
- устранение гиперпластических процессов эндометрия;
- устранение клинических проявлений гиперандрогении — гирсутизма, угревой сыпи.
МЕТАБОЛИЧЕСКИЙ СИНДРОМ
Метаболический синдром — это сочетание различных нарушений обмена веществ и / или заболеваний, вызывающих раннее развитие атеросклероза и его сердечно-сосудистых осложнений. Метаболический синдром у женщин репродуктивного возраста ранее был известен профессионалам как нейрометаболический эндокринный синдром, протекавший как легкая форма болезни Кушинга, гипоталамического или диэнцефального синдрома. У женщин репродуктивного возраста метаболический синдром — одна из самых частых причин нарушения репродуктивной функции на фоне прогрессирующего ожирения и диэнцефальных симптомов.
ЭПИДЕМИОЛОГИЯ
Частота данной патологии составляет до 15-20%, около 30-35% в структуре репродуктивных нарушений и до 70% среди пациентов с рецидивирующими гиперпластическими процессами эндометрия; частота ранних абортов возрастает до 35%.
ЭТИОЛОГИЯ
Причины развития метаболического синдрома — влияние различных факторов (психическое напряжение, нейроинфекции, различные операции, травмы, роды, аборт и др.) У женщин с определенным преморбидным фоном (перенесенное заболевание) (врожденная или приобретенная функциональная лабильность) гипоталамических и внегипоталамических структур).
ПАТОГЕНЕЗ
В основном происходит нарушение нейроэндокринной регуляции гипоталамуса, поэтому имеется множество диэнцефальных симптомов (нарушение сна, аппетита, жажда, головокружение, головная боль, гипертония и др.), Которые указывают на центральный (гипоталамический) генез данной патологии. В ответ на воздействие различных этиологических факторов (стресс) метаболизм нейромедиаторов во внегипоталамических структурах головного мозга нарушается. В результате увеличивается секреция АКТГ, пролактина, нарушается ритм выброса гонадолиберина и, как следствие, гонадотропинов в гипофизе. Экстрагонадно синтезируемый андрогенами, эстрон повышает чувствительность гипофиза к гонадолиберину, что также нарушает функцию гипоталамо-гипофизарной системы яичников с образованием вторичных поликистозных яичников.
Нарушения системы гипоталамус-гипофиз-надпочечники.
В ответ на чрезмерную стимуляцию АКТГ в надпочечниках увеличивается образование всех стероидных гормонов коры: глюкокортикоидов (кортизол), минералокортикоидов (альдостерон) и половых гормонов, в основном андрогенов. Гиперкортизолизму способствует специфическое, так называемое висцеральное ожирение (центральное ожирение, кушингоидное, мужское, андроидное) с преимущественным отложением жировой ткани в плечевом поясе, брюшной полости и брыжейке внутренних органов. Висцеральная жировая ткань приводит к формированию инсулинорезистентности из-за гиперинсулинемии. Также наблюдается нарушение липидного спектра крови (дислипидемия), характеризующееся повышением уровня атерогенных факторов (триглицеридов, липопротеидов низкой плотности, липопротеидов очень низкой плотности) и снижением уровня липопротеидов высокой плотности, что приводит к атеросклерозу и артериальной гипертонии. В этом случае последовательность развития нарушений обмена веществ соответствует длительности заболевания. Следовательно, артериальная гипертензия, важный компонент метаболического синдрома, обычно возникает после 35 лет. Булимия (повышенный аппетит и чрезмерное потребление пищи) также способствует висцеральному ожирению. Периферической инсулинорезистентности также способствуют андрогены надпочечников и тестостерон, вырабатываемые жировой тканью.
Следовательно, после активации оси «гипоталамус-гипофиз надпочечников» формируются 4 основных компонента («квартет смерти») метаболического синдрома: висцеральное ожирение, инсулинорезистентность, дислипидемия и артериальная гипертензия.
Система гипоталамус-гипофиз-яичники. У женщин с метаболическим синдромом поликистоз яичников формируется не только из-за нарушения обмена веществ, но и из-за первичного нарушения нейромедиаторного контроля над функцией гонадолиберина. В яичниках нарушается процесс овуляции, сначала происходит стойкость фолликулов, затем их атрезия. В атретических фолликулах вырабатывается избыток андрогенов и возникает дефицит эстрадиола. Согласно механизмам отрицательной обратной связи, снижение концентрации эстрадиола стимулирует избыточную продукцию ЛГ. Андрогены яичников усугубляют процесс кистозной атрезии фолликулов, способствуют гиперплазии клеток теки и стромы, а также утолщению белочной оболочки яичника. Избыток андрогенов, в основном из надпочечников, а затем из поликистозных яичников в жировую ткань, увеличивает синтез эстрона. Большие концентрации экстрагонадного эстрона повышают чувствительность гипофиза к гонадолиберину, что приводит к хронической гиперсекреции ЛГ и замыкает «порочный круг» в формировании вторичных поликистозных яичников.
КЛИНИЧЕСКАЯ КАРТИНА
Кардинальный признак метаболического синдрома — нарушение менструальной и генеративной функции на фоне увеличения массы тела на 10-30 кг.
В основном пациенты жалуются на нарушения менструального цикла, выкидыш, бесплодие, чрезмерный рост волос, ожирение и различные «диэнцефальные расстройства» (нарушения сна, аппетита, жажды, головокружения, головной боли, гипертонии и т.д.). Кроме того, избыточная масса тела пациента связана с эндокринными нарушениями, а не с диетическими факторами. Только при тщательно собранном анамнезе можно выявить наличие повышения аппетита, основного фактора ожирения.
ПРЕДМЕНСТРУАЛЬНЫЙ СИНДРОМ
Предменструальный синдром (ПМС) — это патологический симптомокомплекс, проявляющийся нервно-психическими, вегетативно-сосудистыми и метаболическими эндокринными нарушениями во второй фазе менструального цикла.
СИНОНИМЫ
Синдром предменструального напряжения, предменструальные заболевания, циклические заболевания. В возрасте до 30 лет частота ПМС составляет 20%, после 30 лет ПМС встречается примерно у каждой второй женщины. Кроме того, ПМС чаще наблюдается у эмоционально лабильных женщин с астеническим телосложением и недостаточным весом. ПМС чаще встречается у женщин, занимающихся умственным трудом.
ЭТИОЛОГИЯ
Факторы, способствующие возникновению ПМС, включают стрессовые ситуации, нейроинфекции, осложненные роды и выкидыш, различные травмы и операции.
ПАТОГЕНЕЗ
Существует множество теорий развития ПМС, каждая из которых объясняет патогенез возникновения различных симптомов: гормональных, теории «водной интоксикации», психосоматических, аллергических расстройств и т.д.
КЛИНИЧЕСКАЯ КАРТИНА
Психоневрологическая форма ПМС характеризуется следующими симптомами: эмоциональная лабильность, раздражительность, плач, бессонница, агрессия, апатия по отношению к окружающей среде, депрессия, слабость, утомляемость, обонятельные и слуховые галлюцинации, нарушения памяти, страх, меланхолия, смех или необузданный плач, сексуальные расстройства, суицидальные мысли. Помимо нервно-психических реакций, которые выходят на первый план, в клинической картине могут быть и другие симптомы: головная боль, головокружение, нарушение аппетита, болезненность молочных желез и отек.
Отечная форма ПМС характеризуется преобладанием в клинической картине следующих симптомов: отек лица, ног, пальцев, нагрубание и болезненность молочных желез (мастодиния), зуд, потливость, жажда, увеличение веса, нарушение функции со стороны желудочно-кишечного тракта (запор, метеоризм, диарея), боли в суставах, головная боль, раздражительность и т д.
Головная форма ПМС характеризуется вегетативно-сосудистыми и неврологическими симптомами: мигренеподобными головными болями с тошнотой, рвотой и диареей (типичные проявления гиперпростагландинемии), головокружением, учащенным сердцебиением, болью в сердце, бессонницей, раздражительностью, повышенной чувствительностью к запахам, агрессией. Головная боль имеет специфический характер (спазмы, пульсация в области висков с отеком век) и сопровождается тошнотой и рвотой. В анамнезе у этих женщин часто наблюдались нейроинфекции, черепно-мозговые травмы и психическое напряжение. Семейный анамнез больных ПМС часто отягощается сердечно-сосудистыми заболеваниями, гипертонией, патологией желудочно-кишечного тракта.
При критической форме ПМС в клинической картине преобладают симпатические кризы надпочечников, сопровождающиеся повышением артериального давления, тахикардией, болями в области сердца, чувством страха без изменений на электрокардиограмме. Приступы часто заканчиваются обильным мочеиспусканием. Как правило, кризисы возникают после переутомления, стрессовых ситуаций. Кризисное течение ПМС может быть результатом нелеченной нервно-психической, отечной или головной формы ПМС на стадии декомпенсации и наступает после 40 лет. Подавляющее большинство пациентов с судорожной формой ПМС имеют заболевания почек, сердечно-сосудистой системы и желудочно-кишечного тракта.
В зависимости от количества симптомов ПМС, их продолжительности и степени выраженности различают легкую и тяжелую форму ПМС:
- Легкая форма ПМС — это появление 3-4 симптомов за 2-10 дней до менструации при значительной степени выраженности 1-2 симптома.
- Тяжелая форма ПМС — это появление 5-12 симптомов за 3-14 дней до менструации, из которых 2-5 или все значительно выражены.
Этапы:
- Компенсированная фаза — появление симптомов в предменструальном периоде, с наступлением менструации симптомы исчезают. С годами проявления ПМС не прогрессируют.
- Субкомпенсированная стадия: с годами тяжесть ПМС прогрессирует, увеличивается продолжительность, количество и тяжесть симптомов.
- Декомпенсированная стадия: тяжелое течение ПМС, постепенно сокращаются «легкие» промежутки.
Лабораторные и инструментальные исследования:
- Гормональные исследования включают измерение уровня пролактина, прогестерона и эстрадиола во второй фазе цикла.
- Дополнительные методы обследования назначаются в зависимости от формы ПМС.
- При тяжелых симптомах со стороны мозга (головная боль, головокружение, шум в ушах, нарушение зрения) показана КТ или МРТ, чтобы исключить новообразования.
- Электроэнцефалография.
- При отечной форме ПМС показано измерение диуреза, исследование выделительной функции почек.
- При болях и отеке молочных желез проводится УЗИ, маммография.
- Консультации специалистов: невропатолог, психиатр, терапевт, эндокринолог.
СИНДРОМ ПОСЛЕ ТОТАЛЬНОЙ ОВАРИЭКТОМИИ
Синдром после тотальной овариэктомии развивается у пациенток репродуктивного и пременопаузального возраста после тотальной овариэктомии с возникновением вегетативно-сосудистых, нервно-психических и метаболических эндокринных нарушений.
СИНОНИМЫ: Посткастрационный синдром, синдром хирургической менопаузы (индуцированный.
Гистерэктомия с удалением придатков матки проводится довольно часто, среди операций на брюшной полости ее доля составляет 38% в России, 25% в Великобритании, 36% в США, 35% в Швеции. Частота СПТ составляет 70-80% и колеблется от 55 до 100% в зависимости от возраста пациента на момент операции, что в среднем составляет 43 +/- 5,7 года. Чаще СПТ развивается у оперированных в пременопаузе женщин с сахарным диабетом, тиреотоксическим зобом.
КЛАССИФИКАЦИЯ
В зависимости от выраженности клинических проявлений различают легкую, среднюю и тяжелую степени течения симптомокомплекса после тотальной овариэктомии.
ЭТИОЛОГИЯ
В SPTO триггером является выраженный гипоэстрогенизм, возникающий в результате удаления функционирующих яичников.
Клиническая картина
СПТО развивается после двустороннего удаления яичников (реже — после одностороннего) и включает вегето-сосудистые, психоневрологические и метаболические эндокринные нарушения, возникающие в результате гипоэстрогении. Множественность проявлений гипоэстрогении обусловлена широким спектром биологического действия половых гормонов.
Психоэмоциональные расстройства могут возникать как в первые дни послеоперационного периода, так и более чем через месяц. Различают астенические проявления (37,5%), депрессивные (40%), фобические, параноидальные, истерические, боязнь замкнутого пространства (22%). Их формированию, помимо гормонального дефицита, способствует травматическая операция, воспринимаемая пациенткой как «снятие женственности».
Вегето-невротические расстройства формируются через 3-4 дня после овариэктомии. Больные в 88% случаев отмечают приливы, озноб, чувство ползания мурашек, плохую переносимость жары. У 45% пациентов развиваются различные нарушения сна, у 40% — сердечно-сосудистые проявления (тахикардия, учащенное сердцебиение и нарушение работы сердца, давящие боли в области сердца, повышение систолического артериального давления). У 25% прооперированных в течение года вегетативно-невротические и психоэмоциональные расстройства исчезают самостоятельно без какой-либо коррекции, у пациентов репродуктивного возраста ремиссия наступает чаще — у 70%.
Метаболико-эндокринные и урогенитальные расстройства (УГР) появляются хронологически позже психоэмоциональных и нейровегетативных проявлений, более чем через год после операции. Среди прооперированных женщин значительно выше заболеваемость ожирением, сахарным диабетом и ишемической болезнью сердца. После удаления яичников риск инфаркта миокарда увеличивается в 2-3 раза, у пациентов выше уровень смертности от сердечно-сосудистых заболеваний. УГР (диспареуния, дизурические явления, кольпит, пролапс) наблюдаются у 20-50% пациентов через 3-5 лет после операции. Они возникают как вследствие гипоэстрогенных метаболических и трофических изменений тканей, так и в результате нарушения архитектуры тазового дна при гистерэктомии.
Двустороннее удаление придатков матки способствует ускорению процессов остеопороза. Заболеваемость остеопорозом среди пациентов с ПТС выше, чем у их неоперированных сверстников.
Лабораторно инструментальные исследования:
- У пациентов с СПТО также определяется уровень гормонов в сыворотке крови (ЛГ, ФСГ, эстрадиол). При необходимости прибегают к дополнительным методам диагностики: урогенитальные нарушения (уродинамическое исследование, УЗИ, цистоскопия), остеопороз (денситометрия, рентгенография).
- При необходимости проконсультируйтесь с урологом, маммологом, психологом, эндокринологом
ПОСТГИСТЕРЭКТОМИЧЕСКИЙ СИНДРОМ
Постгистерэктомический синдром (ПС) — это клинический симптомокомплекс, развивающийся после гистерэктомии (удаления матки) с сохранением одного или двух яичников, характеризующийся психовегетативными и метаболическими нарушениями.
ЭПИДЕМИОЛОГИЯ
Каждая пятая женщина в жизни подвергается гистерэктомии. Наибольшее количество гистерэктомий приходится на наиболее социально активный период жизни женщины (40-49 лет). Частота потери функции яичников, которая приводит к развитию ПГС, колеблется от 20% до 80% и зависит от возраста пациентки. ASG резко снижает качество жизни женщины.
КЛАССИФИКАЦИЯ
Во время события различают раннюю и позднюю ПГС. Симптомы раннего ПС возникают с первых дней послеоперационного периода. Проявления, возникшие через 1 месяц после операции и до года, относятся к поздним проявлениям патологического симптомокомплекса.
По длительности проявлений различают преходящие и стойкие ПГС. Преходящая форма характеризуется восстановлением функции яичников в сроках от месяца до года, стойкая ПГС сохраняется более года со дня операции. Выраженность клинических проявлений определяет легкую, среднюю и тяжелую степень патологического симптомокомплекса.
ЭТИОЛОГИЯ
Типичные проявления ПГС (нейровегетативные, психоэмоциональные и метаболико-эндокринные расстройства).
МЕХАНИЗМ РАЗВИТИЯ
Причиной формирования гипоэстрогении при ПГС принято считать нарушение микроциркуляции яичников и развитие острой ишемии из-за исключения ветвей маточных артерий из их кровоснабжения.
КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА
Клиническая картина ПГС состоит из двух основных симптоматических комплексов: психоэмоциональных расстройств и нервно-вегетативных расстройств. Психоэмоциональные проявления возникают у 44% больных и обычно выражаются в виде астенической депрессии с характерными расстройствами в виде сильной утомляемости, снижения работоспособности, вялости, сильной слабости, повышенного плача, «приливов». У 25% пациентов возникает тревога, сопровождающаяся немотивированным страхом внезапной смерти. Прекращение менструальной и фертильной функции в репродуктивном возрасте часто воспринимается как потеря женственности; возникает чувство страха, страх распада семьи, самооценка как неадекватного сексуального партнера.
Нервно-вегетативные симптомы могут наблюдаться у 30-35% пациентов, которые жалуются на плохую переносимость высоких температур, учащенное сердцебиение в покое, озноб, озноб, онемение и ползание мурашек, «приливы», нарушения сна, вестибулопатию, повышенное потоотделение, склонность к отек, преходящая гипертензия.
