Синдром Клайнфельтера как причина бесплодия. Синдром Клайнфельтера — хромосомная аберрация, приводящая к появлению генотипа 47, XXY в 90% случаев и мозаицизма 46, XY / 47, XXY — в 10% случаев. Обычно мужчины с синдромом Клайнфельтера — высокие, эунукоиды с азооспермией, гинекомастией и маленькими твердыми яичками. Однако существует изменчивость фенотипа, особенно мозаичной формы.
Диагноз подтверждается анализом кариотипа. Имеются сообщения об успешном сборе спермы с последующим ICIS, однако генетическое консультирование пары должно быть обязательным до операции, чтобы определить риск передачи генетической аномалии потомству.
Муковисцидоз как причина бесплодия. Муковисцидоз — наиболее частая аутосомно-рецессивная генетическая аномалия у представителей европеоидной расы. При этом заболевании наблюдается врожденное отсутствие семявыносящего протока, а также легочная патология и внешнесекреторная недостаточность поджелудочной железы. Пациенты несут мутацию в гене CFTR. Этот ген отвечает за синтез белка, участвующего в образовании хлорных каналов, и его мутации нарушают работу этих каналов. Механизмы нарушения развития семявыносящего протока при этих мутациях остаются неясными.

Заподозрить атипичную форму муковисцидоза следует у внешне здорового мужчины с азооспермией и двусторонним отсутствием семявыносящего протока, выявленным при обследовании. Более чем у половины этих пациентов будут мутации CFTR. В связи с высокой частотой переноса гена муковисцидоза в популяции рекомендуется проводить скрининговое исследование на наличие мутаций в гене CFTR для всех мужчин с врожденным отсутствием семявыносящего протока и их супругов.
важно, чтобы пары с высоким риском зачатия эмбриона с гомозиготной мутацией в гене муковисцидоза получали генетическое консультирование и тестирование до сбора спермы и ICIS.
Микроделеции Y-хромосомы как причина бесплодия. Длинное плечо (q) Y-хромосомы содержит три области, мутации которых могут привести к азооспермии или тяжелой олигоспермии. Эти участки, называемые AZF (факторы азооспермии), разделены на зоны a, b и c. Тестирование на микроделецию Y-хромосомы следует проводить у всех мужчин с тяжелой необструктивной олигоспермией или азооспермией.
Имеются сообщения об успешном зачатии после ICIS у мужчин с делециями AZFc. У людей с делециями AZFa или AZFb при биопсии яичек сперматозоиды не обнаруживаются. Хотя потомство самцов с делецией AZFc не обнаруживает видимых соматических изменений, паре следует сообщить, что делеция будет наследственной и что их потомство мужского пола столкнется с теми же репродуктивными проблемами в будущем.
Издатель: Искандер Милевски. Дата обновления публикации: 18.3.2021
Генетические факторы мужского бесплодия, их сочетания и спермиологическая характеристика мужчин с нарушением фертильности
Н.Ю. Сафина 1, Т.А. Яманди 1, В.Б. Черных 2, 3, Л.В. Акуленко 1, С.В. Боголюбов 4, И.И. Витязева 4, О.П. Рыжкова 2, А.А. Степанова 2, Т.А. Адян 2, Е.А. Гемелли 2, А.В. Поляков 2
1 ФГБОУ ВО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова» Минздрава России; Россия, 127473 Москва, ул. Делегатская, 20, стр. 1;
2 ФГБУН «Центр медицинских генетических исследований»; Россия, 115522 Москва, ул. Москворечье, 1;
3 ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н. И. Пирогова» Минздрава России, Россия, 117437 Москва, ул. Островитянова, 1;
4 ФГБУ «Национальный медицинский исследовательский центр эндокринологии» Минздрава России; Россия, 117036 Москва, ул. Дмитрия Ульянова, 11 Контакты: Наталья Юрьевна Сафина natal.s@mail.ru
Вступление
Бесплодие диагностируется у 5-7% мужчин в общей популяции . Репродуктивные дисфункции могут быть вызваны генетическими, экологическими или комбинированными факторами. Генетические факторы нарушения фертильности включают хромосомные и генетические мутации, эпигенетические изменения. Хромосомные аномалии, которые вызывают нарушение фертильности у мужчин, представляют собой количественные аномалии половых хромосом (синдром Клайнфельтера, гоносомный мозаицизм, сбалансированные структурные перестройки хромосом и несбалансированные перестройки хромосом, вариация числа копий) [2].
К частым генетическим нарушениям, связанным с мужским бесплодием, относятся синдром Клайнфельтера, микроделеции Y-хромосомы, мутации и полиморфизмы в гене муковисцидоза (CFTR) и в гене рецептора андрогенов (AR / HUMARA) [3].
Наиболее изученными микроструктурными хромосомными перестройками при мужском бесплодии являются микроделеции длинного плеча хромосомы Y. Они встречаются с частотой примерно 1 на 1000 мужчин [4]. Делеции AZF могут быть полными, т.е они полностью удаляют одну или несколько областей локуса AZF (AZFa, AZFb или AZFc), и частичными, не захватывая полностью ни одну из областей AZF. Почти все полные делеции AZF являются мутациями de novo и вызывают секреторную азооспермию или тяжелую олигозооспермию. Влияние частичных делеций AZF на сперматогенез и мужскую фертильность может быть отрицательным, а может и не быть [5].
Мутации в гене CFTR довольно часто встречаются у мужчин с нарушенной фертильностью. Они вызывают муковисцидоз, синдром врожденной двусторонней аплазии семявыносящего протока (CBAVD), обструктивную форму азооспермии [6, 7].
У мужчин с нарушенной фертильностью наблюдаются различные варианты полиморфизма CAG в экзоне 1 гена AR / HUMARA. Нарушение сперматогенеза чаще выявляется у носителей «длинных» аллелей CAG (27 и более), чем у фертильных мужчин [3, 8].
Анализ научных публикаций свидетельствует о том, что, несмотря на большое количество исследований, до сих пор нет четкой классификации генетических причин мужского бесплодия, учитывающей все фенотипические формы и проявления. Комбинации различных генетических факторов, снижающих фертильность, их клинические последствия и фенотипические эффекты изучены мало или частично.
Цель исследования — установить частоту генетических факторов, влияющих на мужскую репродуктивную функцию, их комбинации, а также изучить их влияние на сперматогенез и сперматологические параметры.
Материалы и методы
Мы рассмотрели 393 неродственных российских мужчины, подавших заявление о бесплодии в браке. Было проведено стандартное молекулярное, цитогенетическое и спермиологическое генетическое исследование (микроделеции локуса AZF, мутации и полиморфизмы гена CFTR и количество повторов CAG гена AR).
По результатам цитогенетического исследования было сформировано 3 группы: 1-я группа — 135 мужчин с числовыми отклонениями половых хромосом (с синдромами Клайнфельтера, дисомией Y-хромосомы); 2-я группа — 58 мужчин со сбалансированными структурными мутациями хромосом (реципрокные и робертсоновские транслокации, инверсии); 3-я группа — 200 человек с нормальным кариотипом (46, XY).
Стандартный анализ спермы проводился по общепринятой методике; его результаты оценивались в соответствии с критериями руководства Всемирной организации здравоохранения по лабораторному исследованию эякулята человека и взаимодействия сперматозоидов со слизью шейки матки [9].
Для цитогенетического исследования использовали препараты метафазных хромосом культивируемых лимфоцитов периферической крови по стандартной методике с окрашиванием ГТГ. Результаты цитогенетического исследования представлены в соответствии с Международной системой цитогенетической номенклатуры хромосом человека [10]
Молекулярно-генетические исследования проводили на ДНК, выделенной из лимфоцитов периферической крови, с использованием набора реагентов для выделения ДНК Prep100 в соответствии с протоколом производителя.
Метод мультиплексной амплификации использовался для поиска микроделеций хромосомы Y. Для определения микроделеций в локусе AZF использовался набор из 19 маркеров (SRY, ZFY, sY84, sY86, sY127, sY134, sY254, sY255, sY615, sY1237, sY1235, sY121, sY124, sY1302, sY142, sY142 .. Методика была подробно описана ранее [11].
Ген CFTR был проанализирован на наличие 22 частых мутаций (F508del, CFTRdele2,3 (21kb), 394delTT, I507del, 1677delTA, 2143delT, 2184insA, 394delTT, 3821delT, L138ins, G542X, W1282X, N13033C> 3944C 621, E92 + 1Kq> 4022insT, 4015delA, 3272-26A> T), что составляет примерно 77% от общего числа поврежденных хромосом, а также полиморфизм IVS8-Tn. Методика подробно описана ранее [6].
Для анализа полиморфизмов CAG экзона 1 AR / HUMARA мы использовали подход, предложенный RCAllen et al. [12].
Статистический анализ проводился с использованием пакета программ Microsoft Office 2013 Excel с использованием точного критерия Пирсона χ2. Различия считались достоверными при уровне вероятности p 0,05).
Частые мутации IVS8-5T и полиморфизмы гена CFTR были проанализированы у 164 пациентов: 25 мужчин в группе 1, 16 пациентов в группе 2, 123 пациента в группе 3. Мутации или IVS8-5T (аллель 5T — легкая вариабельная мутация гена. CFTR) обнаружены у 18 пациентов: у 2 пациентов группы I (5T), у 3 мужчин группы 2 (мутация и гомозиготность по 5T), у 13 пациентов третьей группы (3 мутации и 10 аллелей 5T). Между этими группами не было значимых различий в частоте мутаций (χ2 = 0,971; p> 0,05). Были обнаружены следующие мутации: у 8 пациентов был аллель 5T, у 3 были гетерозиготные мутации (F508del / N, 2184insA / N, N1303K / N), у 2 были мутации CFTR в сложном гетерозиготном состоянии с IVS8-5T (mutCFTR / 5T), что характерен для генотипа, не вызывающего муковисцидоза, но приводящего к развитию синдрома CBAVD и обструктивной азооспермии у мужчин.
Полиморфизм числа CAG-повторов в экзоне 1 гена AR / HUMARA изучен у 152 мужчин: у 86 пациентов 1-й группы, 16 пациентов 2-й группы и 52 пациентов 3-й группы. Количество повторов CAG варьировалось от 14 до 37. Среднее количество повторов CAG существенно не различалось между группами и составляло 22 ± 3 в группе 1, 22 ± 3 в группе 2 и 23 ± 3 в группе 3. Полные мутации этот локус гена AR (количество повторов CAG больше 40) не был обнаружен ни у одного из испытуемых. Более высокое количество повторов CAG (≥ 27) было обнаружено у 11 (13%) пациентов в группе 1, у 1 (7%) пациентов в группе 2 и 7 (13,4%) пациентов в группе 3. Число уменьшилось (≤ 17) CAG-повторы обнаружены у 5 (5,8%) мужчин с синдромом Клайнфельтера и у 1 (7%) пациента 2-й группы. Среди пациентов 3-й группы отсутствовали «короткие» аллели CAG. Достоверных различий в частоте «длинных» аллелей CAG между пациентами с нормальным и аномальным кариотипом не было (χ2 = 0,003; p> 0,5).
Спермологическая характеристика мужчин с репродуктивными нарушениями с числовыми отклонениями половых хромосом (группа 1). В эту группу вошли 120 пациентов с синдромом Клайнфельтера и 15 пациентов с дисомией Y-хромосомы с их мозаичными или другими цитогенетическими вариантами (таблица 1).
Наиболее частым цитогенетическим вариантом синдрома Клайнфельтера является кариотип 47, XXY, который выявлен у 105 пациентов (87,5%). Мозаичные формы и другие цитогенетические варианты синдрома Клайнфельтера обнаружены у 15 пациентов (12,5.
Среди мужчин с дисомией Y-хромосомы ее правильная форма — кариотип 47, XYY — выявлена у 13 (86,6%). Вариант мозаики 46, XY / 47, XYY и комбинация дисомии Y-хромосомы с транслокацией Робертсона — 46, XYY, der (13; 14) (q10; q10) были обнаружены у 2 мужчин (13,4%) с дисомией Y-хромосомы).
В 1-й группе исследование спермы выполнено 87 пациентам, в том числе 76 с синдромом Клайнфельтера и 11 с дисомией по хромосоме Y. У остальных пациентов анализ эякулята не проводился из-за недоступности биологического материала. Нарушения сперматогенеза разной степени выраженности диагностированы у всех обследованных пациентов (табл. 1).
Таблица 1. Цитогенетическая и сперматологическая характеристика пациентов 1-й группы
| Кариотип | Количество пациентов | Форма патозооспермии | Количество пациентов | |||
| брюшные мышцы | % | брюшные мышцы. | % | |||
| Цитогенетические варианты синдрома Клайнфельтера | ||||||
| 47, XXY | 105 | 87,5 | Азооспермия | 55 | 52,4 | |
| Тяжелая олигоастенотератозооспермия | 6 | 5,7 | ||||
| Криптозооспермия | 2 | 1.9 | ||||
| mos 46, XY / 47, XXY | девять | 12 | 10 | Азооспермия | 7 | 58,3 |
| 2 | 16,6 | |||||
| плюс 46, XX / 47, XXY | 1 | Астенотератозооспермия | 2 | 16,6 | ||
| плюс 46, XY / 46, XX / 47, XXY | 1 | Азооспермия | 1 | 8,3 | ||
| плюс 46, XY / 47, XXY / 48, XXXY | 1 | Тяжелая олигоастенотератозооспермия | ||||
| Цитогенетические варианты синдрома дисомии Y-хромосомы | ||||||
| 47, XYY | 13 | 86,7 | Азооспермия | 4 | 36,3 | |
| Тяжелая олигоастенотератозооспермия | 5 | 45,4 | ||||
| Астенотератозооспермия | 1 | девять | ||||
| Астенозооспермия | 1 | девять | ||||
| mos 46, XY / 47, XYY | 1 | 0,7 | Нежелательный | — | — | |
| 46, XYY, der (13; 14) (q10; q10) | 1 | 0,7 | Нежелательный | — | — |
Азооспермия или криптозооспермия выявлена у 67 (88%), тяжелая олигоастенотератозооспермия — у 7 (9%), астенотератозооспермия — у 2 (2,6%), астенозооспермия — у 3% обследованных сперматозоидов с синдромом Клайнфельтера. Азооспермия была обнаружена у 4 (36,4%), олигоастенотератозооспермия — у 5 (45,5%), астено- / тератозооспермия — у 2 (18%) спермологически обследованных пациентов с дисомией Y-хромосомы.
Молекулярно-генетический анализ выявил различные генетические факторы у 23 (17%) из 123 обследованных пациентов 1-й группы: у 12 пациентов с синдромом Клайнфельтера, у 3 пациентов с дисомией Y-хромосомы — частичные делеции области AZFc (b2 / b3, gr. / gr), у 7 пациентов с синдромом Клайнфельтера — увеличение (27 и более), у 2 — небольшое количество (17 и менее) повторов CAG в экзоне 1 гена AR / HUMARA. Гетерозиготность по аллелям CAG определена у 55 пациентов, гомозиготность — у 53 пациентов с синдромом Клайнфельтера, в том числе среди мозаик гетерозигот — 3, гомозигот — 9.
У всех пациентов с сочетанием хромосомных аномалий и генетических мутаций / факторов снижения мужской фертильности наблюдались тяжелые формы патзооспермии (таблица 2).
Таблица 2. Комбинации аномалий половых хромосом с генетическими факторами, связанными с нарушением фертильности у мужчин
| Генотип | Количество пациентов, n = 23 | Тип патозооспермии | Количество пациентов, n = 21 | ||
| брюшные мышцы. | % | брюшные мышцы. | % | ||
| 47, XXY; из b2 / b3 | 5 | 22 | Азооспермия | 4 | 100 |
| 47, XXY; гр / гр | 3 | 13 | Азооспермия | 2 | 100 |
| mos 46, XY / 47, XXY; из b2 / b3 | 2 | девять | Азооспермия | 2 | 100 |
| 47, XXY; CAG˃28 | 5 | 22 | Азооспермия | 5 | 100 |
| 47, XXY; CAG˂16 | 1 | 4 | Нежелательный | – | – |
| 47, XXY; из b2 / b3; CAG˂16 | 1 | 4 | Азооспермия | 1 | 100 |
| mos 46, XX / 47, XXY; CAG˃28 | 1 | 4 | Азооспермия | 1 | 100 |
| 47, XXY; ИВС8-5Т (5Т / 9Т); CAG˃28 | 1 | 4 | Азооспермия | 1 | 100 |
| mos 46, XY / 47, XXY; из b2 / b3; IVS8-5T (5T / 7T) | 1 | 4 | Азооспермия | 1 | 100 |
| 47, XYY; из b2 / b3 | 3 | 13 | Азооспермия | 1 | 33,3 |
| Тяжелая олигоастенотератозооспермия | 2 | 66,6 |
Спермологическая характеристика мужчин с нарушением репродуктивной функции со структурными мутациями хромосом (группа 2). В эту группу вошли 58 пациенток с первичным бесплодием, у которых по результатам цитогенетических исследований выявлены сбалансированные структурные хромосомные мутации. В эту группу вошли 30% обследованных пациентов с хромосомными аномалиями.
В спектре исследованных структурных хромосомных мутаций больше всего были сбалансированные (в основном аутосомные) реципрокные транслокации, обнаруженные у 27 пациентов (47%), а также Робертсоновские транслокации, в основном затрагивающие хромосомы 13 и 14 (кариотип 45, XY, der (13; 14).) (q10; q10)), выявленных у 23 (40%) пациентов. Перицентрические инверсии выявлены у 4 (7%) пациентов, из них аутосомные (хромосомы 7, 18) — у 3, Y-хромосомы — у 1. Сложные хромосомные перестройки выявлены у 3 (5%) пациентов: 46, XY, t (5; 15) (стр.22; q32); т (6; 12) (q15; q21); 46, XY, t (5; 11) (q31.1; q33) t (6; 18) (q25.1; р11.2), сочетание транслокации и инверсии — 46, XY, t (7; 9) (q31; q34) inv (9) (q32; q34). Кольцевая хромосома 22 (кариотип 46, XY, r (22) (:: p11 → q13: :)) обнаружена у 1 человека с азооспермией::)).
Спермологическое исследование выполнено 37 пациентам со структурными хромосомными мутациями (табл. 3). Различные формы патозооспермии диагностированы у 36 (97%) пациентов: азооспермия — у 8 (21%), криптозооспермия — у 1 (3%), тяжелая олигоастенотератозооспермия — у 18 (46%), астенотератозооспермия — у 8 (21%).). Нормозооспермия выявлена у 1 пациента с Робертсоновской транслокацией (13; 14.
Таблица 3. Спермологические характеристики мужчин с репродуктивными нарушениями со структурными хромосомными мутациями
| Тип хромосомной аномалии | Количество пациентов | Тип патозооспермии | Количество пациентов | ||
| брюшные мышцы. | % | брюшные мышцы. | % | ||
| Транслокации | 33 | 89 | Азооспермия | 7 | 18 |
| Олигоастенотератозооспермия | 17 | 43,5 | |||
| Астенотератозооспермия | 7 | 18 | |||
| Криптозооспермия | 1 | 2,6 | |||
| Нормозооспермия | 1 | 2,6 | |||
| Инверсии | 2 | 5.5 | Олигоастенотератозооспермия | 1 | 2,6 |
| Астенотератозооспермия | 1 | 2,6 | |||
| Кольцевая хромосома (22) | 1 | 2,7 | Азооспермия | 1 | 2,6 |
| Транслокация, инверсия | 1 | 2,7 | Астенозооспермия | 1 | 2,6 |
Молекулярно-генетическое исследование 11 (19%) из 58 пациентов 2-й группы выявило сочетание структурных мутаций хромосом с другими генетическими факторами бесплодия (микроделеции Y-хромосомы, мутации гена CFTR и «короткое» или «короткое» или «короткое» длинные «» CAG-повторы гена AR).
У человека с робертсоновской транслокацией была обнаружена полная делеция области AZFc (b2 / b4) Y-хромосомы (таблица 4). Частичные микроделеции области AZFc (b2 / b3, gr / gr) выявлены у 6 (14,3%) пациентов (от общего числа пациентов с транслокациями) и у 1 пациента с инверсией. У 3 пациентов (3,5%) выявлено сочетание структурных перестроек хромосом и мутаций или аллель 5T гена CFTR.
Таблица 4. Сочетание структурных хромосомных мутаций с генетическими нарушениями, связанными с нарушением фертильности у мужчин
| Тип аномалии / генотип | Количество пациентов | Нарушения сперматогенеза | Количество пациентов | ||
| брюшные мышцы | % | брюшные мышцы | % | ||
| Робертсоновская транслокация, полная делеция (b2 / b4) AZFc | 1 | 1.6 | Тяжелая олигоастенотератозооспермия | 1 | 100 |
| Робертсоновская транслокация, частичная делеция AZFc (del b2 / b3) | 4 | 6.4 | Тяжелая олигоастенотератозооспермия | 3 | 75 |
| Робертсоновская транслокация, вариант IVS8-5T гена CFTR | 2 | 3.2 | Астенозооспермия | 2 | 100 |
| Реципрокная транслокация, частичная делеция AZFc (del b2 / b3) | 2 | 3.2 | Тяжелая олигоастенотератозооспермия | 2 | 100 |
| Взаимная транслокация, мутация CFTR N1303K/- | 1 | 1.6 | Азооспермия | 1 | 100 |
| Аннулирование, частичная отмена AZFc (del b2 / b3) | 1 | 1.6 | Нежелательный | – | – |
Таким образом, у пациентов с сочетанием хромосомных и генетических мутаций выявлялись преимущественно тяжелые формы патозооспермии (азооспермия, тяжелая олигозооспермия).
Спермологическая характеристика мужчин с нарушением репродуктивной функции с нормальным кариотипом (группа 3). В эту группу входят пациенты, обратившиеся по поводу первичного бесплодия, у которых при цитогенетическом исследовании не выявлено хромосомных аномалий. В него вошли 200 мужчин с различными формами патозооспермии или измененного сперматогенеза и нормальным мужским кариотипом (46, XY).
В структуре спермологических соотношений у 186 (93%) пациентов 3-й группы наблюдалась тяжелая азооспермия, криптозооспермия или олигозооспермия, у 13 (6,5%) — астено- / тератозооспермия или умеренная олигозооспермия. У 1 пациента диагностирована нормозооспермия (см. Рисунок).
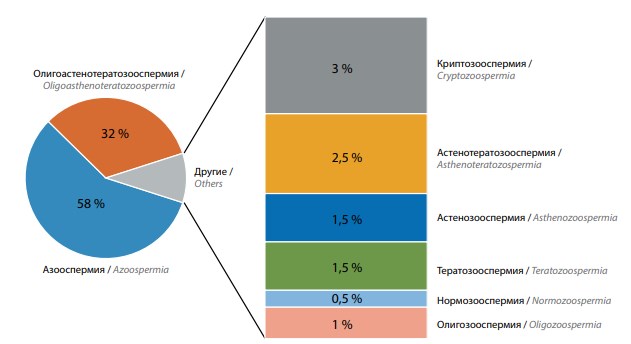
Спектр нарушений спермы у мужчин 3-й группы
В ходе молекулярно-генетического исследования у 56 пациентов (28,7%) 3-й группы были диагностированы различные генетические факторы мужского бесплодия (таблица 5). Полные делеции области AZF (a, b или c) были обнаружены у 19 (34%) мужчин группы 3. Делеции AZFb + c были обнаружены у 5 (9%) пациентов, в том числе 1 в комбинации с вариантом IVS8 -5T гена CFTR в гетерозиготном состоянии (см таблицу 5).
Таблица 5. Типы и частота генетических аномалий у пациентов с нормальным мужским кариотипом (группа 3)
| Тип аномалии / генотип | Количество пациентов | Тип патозооспермии | Количество пациентов | |||
| брюшные мышцы | % | брюшные мышцы | % | |||
| Устранение AZFb + c | 5 | девять | Азооспермия | 5 | 100 | |
| Устранение AZFa | 1 | 1,8 | Азооспермия | 1 | 100 | |
| Устранение AZFb | 4 | 3,6 | Азооспермия | 2 | 50 | |
| Криптозооспермия | 2 | 50 | ||||
| Полное устранение AZFc | 14 | 2,6 | Азооспермия | одиннадцать | 79 | |
| Олигоастенотератозооспермия | 2 | 14 | ||||
| Криптозооспермия | 1 | 7 | ||||
| Частичное устранение AZFc | из b2 / b3 | 12 | 21 год | Азооспермия | 7 | 58 |
| Олигоастенотератозооспермия | 5 | 42 | ||||
| гр / гр | восемь | 14,3 | Азооспермия | 5 | 63 | |
| Олигоастенотератозооспермия | 3 | 38 | ||||
| Мутация CFTR (F508del) | 1 | 1,8 | Азооспермия | 1 | 100 | |
| IVS8-5T (5T / 7T) | 3 | 5,4 | Олигоастенотератозооспермия | 3 | 100 | |
| Полная отмена AZFb + c, IVS8-5T (5T / 7T) | 1 | 1,8 | Азооспермия | 1 | 100 | |
| Частичная отмена AZFc (из b2 / b3; из гр / гр), IVS8-5T (5T / 7T) | 2 | 3,6 | Азооспермия | 1 | 50 | |
| Олигоастенотератозооспермия | 1 | 50 | ||||
| Частичная отмена AZFc (из b2 / b3), CAG = 30 Частичная отмена AZFc (из b2 / b3), CAG = 30 | 1 | 1,8 | Олигоастенотератозооспермия | 1 | 100 | |
| IVS8-5T (5T / 7T) | CAG = 33 | 2 | 3,6 | Азооспермия | 1 | 50 |
| CAG = 28 | Олигоастенотератозооспермия | 1 | 50 | |||
| Мутация CFTR, IVS8-5T | F508del / 5T | 1 | 3,6 | Азооспермия | 1 | 100 |
| 2184insA / 5T | 1 | Азооспермия | 1 | 100 |
Таблица 6. Формы патозооспермии у мужчин с сочетанием различных генетических факторов мужского бесплодия (AZF, CFTR, AR)
| Тип патозооспермии | Тип сочетания генетических факторов | |||||
| Численные хромосомные аномалии, варианты генов, n = 21 | Структурные хромосомные аномалии, варианты генов, n = 10 | Нормальный кариотип, варианты гена, n = 56 | ||||
| брюшные мышцы. | % | брюшные мышцы. | % | брюшные мышцы. | % | |
| Азооспермия | 19 | 90,5 | 1 | 10 | 37 | 66 |
| Тяжелая олигоастенотератозооспермия | 2 | 9,5 | 6 | 60 | 16 | 28,6 |
| Астенотератозооспермия | – | – | 1 | 10 | 3 | 5,4 |
| Астенозооспермия | – | – | 2 | ветры | – | – |
У одного пациента (1,8%) диагностирована мутация F508del в гене CFTR. Мутации в гене CFTR в составной гетерозиготе с вариантом IVS8-5T были обнаружены у 2 (3,6%) пациентов с обструктивной азооспермией (генотипы 2184insA / N, 5T / 7T и F508del / N, 5T / 9T). У 2 мужчин обнаружена комбинация варианта IVS8-5T гена CFTR и увеличения количества CAG-повторов гена AR (генотипы CFTR 5T / 7T; AR CAGn = 28 и CFTR 5T / 7T; CAGn = 33).
Как видно из таблицы. 5, среди генетических факторов (AZF, CFTR и AR) наиболее часто наблюдались микроделеции области AZFc, выявленные у 23 (41%) пациентов 3-й группы. Частичные делеции области AZFc (b2 / b3) были выявлены у 3 мужчин, которые сочетались у одного пациента с повышенным количеством (n = 30) CAG-повторов гена AR и у 2 — с вариантом IVS8-5T гена CFTR в гетерозиготном состоянии. Сочетание нескольких генетических факторов, связанных с нарушением фертильности у мужчин, выявлено у 6 (10,7%) пациентов 3-й группы.
В выявленных случаях сочетания генетических факторов мужского бесплодия во всех 3 группах преобладали тяжелые формы патозооспермии (азооспермия, тяжелая олигоастенотератозооспермия), которые были выявлены у 100, 70 и 94,5% пациентов соответственно. В группах 1, 2 и 3 (Таблица 6)… У мужчин с сочетанием генетических факторов бесплодия не было обнаружено изолированной тератозооспермии и нормозооспермии.
Обсуждение
В этом исследовании впервые были изучены комбинации различных генетических факторов, связанных с нарушением мужской фертильности (AZF, CFTR, AR) у мужчин с нормальным кариотипом и хромосомными мутациями (с числовыми и структурными аномалиями).
В группе пациентов с хромосомными числовыми аномалиями обнаружены частичные делеции AZF, изменения количества CAG-повторов гена AR и полные делеции области AZF, мутаций в гене CFTR не обнаружено. У пациентов со структурными перестройками хромосом были выявлены частичные делеции AZF и мутации в гене CFTR, но «короткие» и «длинные» повторы CAG гена AR не обнаружены. Это может указывать на то, что наличие у пациента двух генетических причин мужского бесплодия (например, хромосомная мутация и полное удаление области AZF) является случайным, редким и, конечно, эти генетические факторы не зависят друг от друга.
У мужчин с бесплодием, не имеющих аномалий кариотипа, частота других изученных генетических факторов, нарушающих сперматогенез (AZF, CFTR и AR), была примерно в 2 раза выше, чем суммарная частота этих факторов в группах пациентов с числовым и структурным хромосомным аномалии. У пациентов с нормальным кариотипом комбинации микроструктурных перестроек Y-хромосомы и вариантов генов (в генах CFTR и AR) выявлялись чаще, чем у пациентов с хромосомными аномалиями. Комбинация двух изменений одного и того же фактора — мутации и аллеля 5T в гене CFTR — может вызвать синдром CBAVD или обструктивную азооспермию.
интересно, что мы обнаружили сходство в структуре патозооспермии исследованных групп.
В частности, азооспермия у мужчин с нормальным кариотипом и у мужчин с хромосомными аномалиями регистрировалась с одинаковой частотой — 58 %.
Наличие дополнительных генетических факторов, по-видимому, не оказало значительного влияния на тяжесть измененного сперматогенеза у пациентов с синдромом Клайнфельтера, у которых изначально была диагностирована азооспермия. Мужчины со структурными аномалиями чаще страдали тяжелой олигозооспермией. Большинство комбинаций генетических факторов, приводящих к тяжелым формам патозооспермии, было обнаружено у пациентов с нормальным кариотипом.
Наличие полной делеции области (ов) AZF, мутации в генах AR или CFTR достаточно для развития генетически детерминированных, обычно первичных, тяжелых форм мужского бесплодия. Эти микроделеции Y-хромосомы характеризуются сильным угнетением сперматогенеза, вплоть до синдрома присутствия только клеток Сертоли и секреторной азооспермии, криптозооспермии или тяжелой олигозооспермии. Наличие в генотипе мутаций или аллеля 5T в гене CFTR может привести к развитию синдрома CBAVD, проявляющегося первичным бесплодием из-за обструктивной азооспермии [6]. Следует подчеркнуть, что наличие частичных микроделеций области AZFc, только 1 мутация или 5T аллель гена CFTR, повышенное или пониженное количество повторов CAG в гене AR не вызывают мужское бесплодие как таковое, а только в сочетании с другими факторами, поскольку снижение фертильности имеет многофакторную этиологию. Чаще всего они наблюдаются у мужчин с тяжелыми формами патозооспермии, особенно с азооспермией и тяжелой олигозооспермией, но обнаруживаются у мужчин с различными параметрами фертильности и спермограммы [3].
Заключение
Это исследование предполагает, что пациенты с бесплодием могут иметь комбинацию 2 или более различных генетических факторов, влияющих на мужскую фертильность. Такие сочетания генетических факторов в генотипе (в частности, микроделеции Y-хромосомы, мутации в гене CFTR и увеличение количества CAG-повторов гена AR) могут чаще встречаться у пациентов с бесплодием. Если они обнаруживаются в сочетании друг с другом, это дает аддитивный эффект, усиливает негативный эффект каждого, усугубляет клинические (фенотипические) проявления. Углубление этой темы очень важно как для понимания причин мужского бесплодия, выбора адекватной стратегии лечения, в том числе с помощью вспомогательных репродуктивных технологий, так и для планирования профилактики генетических заболеваний у потомства.
Литература
- Skakkebaek NE, Rajpert-De Meyts E, Buck Louis GM et al. Нарушения репродуктивной функции у мужчин и тенденции фертильности: влияние окружающей среды и генетическая предрасположенность. Physiol Rev 2016; 96 (1): 55-97. DOI: 10.1152 / Physrev.00017.2015 / PMID: 26582516.
- Курило Л.Ф., Сорокина Т.М., Черных В.Б и др. структура генетически обусловленных заболеваний органов репродуктивной системы. Андрология и генитальная хирургия 2011; (3): 17-25. [Курило Л.Ф., Сорокина Т.М., Черных В.Б и др. структура и патогенез наследственных заболеваний органов репродуктивной системы человека. Андрология и генитальная хирургия = Андрология и генитальная хирургия 2011; (3): 17-25. (На русском.)].
- Черных В.Б., Руднева С.А., Сорокина Т.М и др. слияние CAG-полиморфизма гена рецептора андрогенов (АР) на сперматогенез у мужчин с бесплодием. Андрология и генитальная хирургия 2015; 16 (4): 55-61. [Черных В.Б., Руднева С.А., Сорокина Т.М. Влияние СAG-полиморфизма гена андрогенных рецепторов (АР) на сперматогенез у бесплодных мужчин. Андрология и генитальная хирургия = Андрология и генитальная хирургия 2015; 16 (4): 55-61. (На русском.)]. DOI: 10.17650 / 2070-9781-2015-16-4-55-61.
- Krausz S., Hoefsloot L., Simoni M., Tüttelmann F. Рекомендации EAA / EMQN по передовой практике для молекулярной диагностики хромосомных микроделеций: современное состояние 2013. Андрология 2014; 2 (1): 5–19. DOI: 10.1111 / j.2047-2927.2013.00173.x. PMID: 24357628.
- В.Б. Черных делеции AZF — частая генетическая причина мужского бесплодия: современные исследования. Выпуски репродукции 2009 г .; (1): 10–5. Делеции Chernykh VB AZF как частая генетическая причина мужского бесплодия: современное состояние исследований. Проблемные репродукции = Российский журнал репродукции человека 2009; (1): 10-5. (На русском.).
- Черных В.Б., Степанова А.А., Бескоровая Т.С и др. састота и спектр мутаций и полиморфизм IVS8-T гена CFTR среди российских мужчин с бесплодием. Генетика 2010; 46 (6): 844-52. [Черных В.Б., Степанова А.А., Бескоровая Т.С и др. састота и спектр мутаций и полиморфизм IVS8-T гена CFTR у бесплодных мужчин России. Генетика = Российский генетический журнал 2010; 46 (6): 844–52. (На русском.)].
- Штаут М.И., Шилейко Л.В., Репина С.А и др. сомплексное сперматологическое обследование больных муковисцидозом. Андрология и генитальная хирургия 2017, 18 (4): 69-76. [Штаут М.И., Шилейко Л.В., Репина С.А и др. сомплексное исследование спермы пациентов с муковисцидозом. Андрология и генитальная хирургия = Андрология и генитальная хирургия 2017; 18 (4): 69-76. (На русском.)]. DOI: 10.17650 / 2070-97812017-18-4-69-76.
- Ненонен Х.А., Гиверкман А., Халленгрен Э., Гиверкман Ю.Л. Нелинейная связь между длиной повтора CAG рецептора андрогенов и риском субфертильности у мужчин: метаанализ. Int J Androl 2011; 34 (4): 327-32. DOI: 10.1111 / j. 1365-2605.2010.01084.x. PMID: 20579136.
- Рекомендации ВОЗ по исследованию и лечению эякулята человека. 5 изд., 2010 г. По с англ. Н.П. Макаров. Sci ed. LF Копченый. М .: Capital Print, 2012. [Лабораторное руководство ВОЗ по исследованию и обработке спермы человека. 5-е изд., 2010. Трад с англ. Н.П. Макаровой. Научный и Л.Ф. Курило. М .: Капитал Принт, 2012.)].
- ISCN 2013: международная система цитогенетической номенклатуры человека. Рекомендации Международного постоянного комитета по правам человека. Ред .: Л.Г. Шаффер, Дж. Макгоуэн-Джордан, М. Шмид. Базель: Каргер, 2013. 140 с.
- Черных В.Б., Чухрова А.Л., Бескоровая Т.С и др. сипы делеций Y-хромосомы и их частота у мужчин с бесплодием. Генетика 2006; 42 (8): 1130-6. [Черных В.Б., Чухрова А.Л., Бескоровая Т.С и др. сипы делеций y-хромосомы и их частота у бесплодных мужчин. Генетика = Российский генетический журнал 2006; 42 (8): 1130-6. (На русском.)].
- Allen RC, Zoghbi HY, Moseley AB et al. Метилирование сайтов HpaII и HhaI возле полиморфного повтора CAG в гене рецептора андрогенов человека коррелирует с инактивацией хромосомы X. Am J Hum Genet 1992; 51 (6): 1229-39. PMID: 1281384.
Статья опубликована в журнале «Андрология и генитальная хирургия» n. 2 2018, стр. 40-50
